题目内容
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知: C(s)+O2(g) =CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) =2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) =2NO(g) △H 3 =+180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2的热化学方程式是_________________________。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
① 前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
② L、X可分别代表压强或温度。下图A表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系______,并简述理由:______________________________。

(3)实验测得,v正=k正·c2(NO)·c2(CO),v逆=k逆·c(N2) ·c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数______(填“>”、“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol CO和1 mol NO,在一定温度下达到平衡时,CO的转化率为40%,则k正︰k逆 =__________。(保留一位小数)
II. 有人利用反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,用活性炭对NO进行吸附。现在密闭容器中加入足量的C和一定量的NO气体并在催化剂作用下发生反应,经相同时间测得NO的转化率随温度的变化如图B所示。由图可知最高转化率对应温度为450℃。低于450℃时,NO的转化率______(填“是”或者“不是”)对应温度下的平衡转化率,判断理由是________________________;高于450OC时,NO的转化率降低的可能原因是___________(填标号)
A.催化剂活性降低 B.平衡常数变小 C. 反应活化能增大
【答案】2NO(g)+2CO(g)═N2(g)+2CO2(g)△H═-746.5kJmol-1 2.25×10-4 温度 L2>L1 该反应为气体体积减小的反应,压强增大,NO转化率增大 < 0.5 不是 该反应是放热反应,平衡转化率随温度升高而降低 AB
【解析】
I.(1)根据已知热化学方程式,利用盖斯定律的计算方法,进行已知反应方程式的加减,得到目标反应,方程式相加减的同时,焓变也进行相加减。
(2)①利用题中已给表格数据找出前4 s内CO的物质的量浓度变化数据,利用反应速率计算公式求解。
②由图象可知随着x的增大,NO的平衡转化率降低,则平衡逆向移动,可为升高温度,L为不同的压强,增大压强,平衡正向移动,NO的平衡转化率增大,则L2>L1。
(3)①正反应为放热反应,升高温度,平衡逆向移动,则k正增大的倍数<k逆增大的倍数。
②若在2L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则利用三段式求解相关数据,
2NO(g)+2CO(g)N2(g)+2CO2(g)
起始(mol/L):0.50.500
转化(mol/L):0.20.20.10.2
平衡(mol/L):0.30.3 0.10.2
II. 本题考查温度对化学平衡移动的影响,根据反应C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,正反应放热,结合图像中NO转化率的变化,利用温度的变化对化学反应平衡移动的影响进行分析对反应物转化率的影响;该反应在催化剂条件下反生,催化剂的活性也受温度影响,催化剂的活性随温度的变化而变化,在一定温度范围内,催化剂活性最大,温度过高会导致催化剂失去活性,也会导致反应物转化率降低。
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,正反应放热,结合图像中NO转化率的变化,利用温度的变化对化学反应平衡移动的影响进行分析对反应物转化率的影响;该反应在催化剂条件下反生,催化剂的活性也受温度影响,催化剂的活性随温度的变化而变化,在一定温度范围内,催化剂活性最大,温度过高会导致催化剂失去活性,也会导致反应物转化率降低。
I.(1)已知:①C(s)+O2(g)═CO2(g)△H1=-393.5kJmol-1
②2C(s)+O2(g)═2CO(g)△H2=-221.0 kJmol-1
③N2(g)+O2(g)═2NO(g)△H3=+180.5 kJmol-1,利用盖斯定律,将①×2-②-③可得2NO(g)+2CO(g)═N2(g)+2CO2(g)△H═2×(-393.5kJmol-1)-(-221.0 kJmol-1)-(+180.5 kJmol-1)=-746.5 kJmol-1,则热化学方程式为2NO(g)+2CO(g)═N2(g)+2CO2(g)△H═-746.5 kJmol-1,
故答案为:2NO(g)+2CO(g)═N2(g)+2CO2(g)△H═-746.5kJmol-1;
(2)①前4 s内CO的物质的量浓度变化0.9×10-3molL-1,则v=![]() =2.25×10-4 mol·L1·s1,
=2.25×10-4 mol·L1·s1,
故答案为:2.25×10-4;
②由图象可知随着x的增大,NO的平衡转化率降低,则平衡逆向移动,可为升高温度,L为不同的压强,增大压强,平衡正向移动,NO的平衡转化率增大,则L2>L1,该反应为气体体积减小的反应,压强增大,NO转化率增大,
故答案为:温度;L2>L1;该反应为气体体积减小的反应,压强增大,NO转化率增大;
(3)①正反应为放热反应,升高温度,平衡逆向移动,则k正增大的倍数<k逆增大的倍数,故答案为:<;
②若在2L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则
2NO(g)+2CO(g)N2(g)+2CO2(g)
起始(mol/L):0.50.500
转化(mol/L):0.20.20.10.2
平衡(mol/L):0.30.3 0.10.2
平衡时v正=v逆,则k正c2(NO)c2(CO)=k逆c(N2)c2(CO2),
则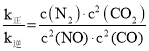 =
= ![]() =0.5
=0.5
答案为:0.5;
II. 根据反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,正反应放热,温度越高反应向逆向进行,NO的转化率降低,当温度低于450℃,降低温度反应应该向放热的方向移动,则NO的转化率应增大,不应该减小,故低于450℃时,NO的转化率不是对应温度下的平衡转化率;由于该反应在催化剂作用下反应,催化剂有一定的活性,450℃是催化剂的活性最大,NO的转化率最大,高于450℃时,会导致催化剂的活性降低,使NO的转化率降低,转化率与平衡常数有关,平衡常数越大,反应物转化率越大,反应进行越彻底,温度升高使反应逆向移动,平衡常数减小,使NO的转化率降低,
N2(g)+CO2(g) ΔH = 34.0 kJ·mol1,正反应放热,温度越高反应向逆向进行,NO的转化率降低,当温度低于450℃,降低温度反应应该向放热的方向移动,则NO的转化率应增大,不应该减小,故低于450℃时,NO的转化率不是对应温度下的平衡转化率;由于该反应在催化剂作用下反应,催化剂有一定的活性,450℃是催化剂的活性最大,NO的转化率最大,高于450℃时,会导致催化剂的活性降低,使NO的转化率降低,转化率与平衡常数有关,平衡常数越大,反应物转化率越大,反应进行越彻底,温度升高使反应逆向移动,平衡常数减小,使NO的转化率降低,
故答案为:不是;该反应是放热反应,平衡转化率随温度升高而降低;AB。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案