【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,有刺激泩气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程是________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是________。
④用下图装置(a、b均为石墨电极)进行实验V:

i. K闭合时,指针向左偏转
ⅱ. 向右管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针偏转幅度变化不大ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针向左偏转幅度增大
将i和ⅱ、ⅲ作对比,得出的结论是________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | …… |
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、________有关。
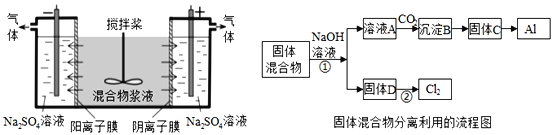
【题目】(1)Ⅰ.太阳能、风能发电逐渐得到广泛应用,在发电系统中安装储能装置有助于持续稳定供电,其构造的简化图如下

下列说法中,不正确的是________ (填字母序号)
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(2)全钒液流电池是具有发展前景的、用作储能系统的蓄电池。已知放电时V2+发生氧化反应,则放电时电极A的电极反应式为________ 。
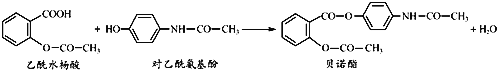
(3)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+, Fe3+)等进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液pH范围不同时,钒的存在形式如下表所示
钒的化合价 | pH<2 | pH>11 |
+4价 | VO2+, VO(OH)+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①加入NaOH调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH后涉及到氧化物还原反应的化学反应方程式为________。
②向碱性的滤液1(V的化合价为+4)中加入H2O2的作用是________ 。
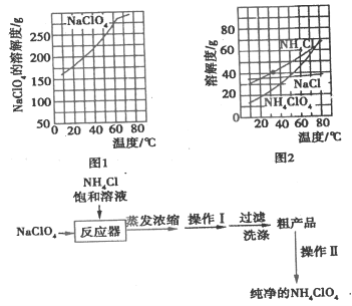
(4)Ⅱ.氨氮废水中的氮元素多以NH4+和NH3·H2O的形式存在。某工厂处理氨氮废水的流程如下:
![]()
Ⅰ中加入NaOH溶液,调pH=11并鼓入大量空气,用离子方程式表示加NaOH溶液的作用是________;鼓入大量空气的目的是________。
(5)Ⅱ中加入适量NaClO溶液,控制pH在6~7,将氨氮转化为无毒物质,过程Ⅱ发生3个反应:
ⅰ.ClO-+H+=HClO
ⅱ.NH4++HClO=NH2Cl+H++H2O(NH2Cl中Cl元素为+1价)
ⅲ. ……
已知:水体中以+1价形式存在的氯元素有消毒杀菌的作用,被称为“余氯”。下图为NaClO加入量与“余氯”含量的关系示意图。其中氨氮含量最低的点是c点。

b点表示的溶液中氮元素的主要存在形式是(用化学式表示) ________;反应ⅲ的化学方程式是________。
(6)Ⅲ中用Na2SO3溶液处理含余氯废水,要求达标废水中剩余Na2SO3的含量小于5mg·L-1。若含余氯废水中NaClO的含量是7.45mg·L-1,则处理10m3含余氯废水,至多添加10%Na2SO3溶液________kg(溶液体积变化忽略不计)。