题目内容
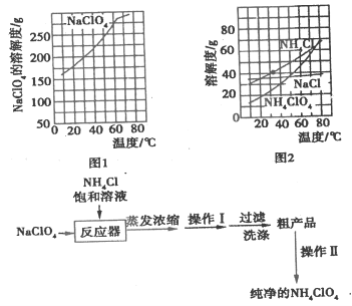
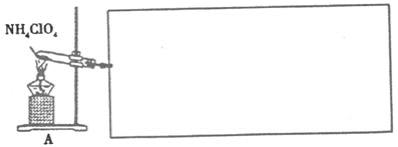
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室用NaClO4、NH4Cl等原料制取(部分物质的溶解度如图1、图2),其实验流程如图3:
(1)反应器中发生反应的基本反应类型是________。
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为________。
(3)洗涤粗产品时,宜用________(填“0℃冷水”或“80°C热水”)洗涤。
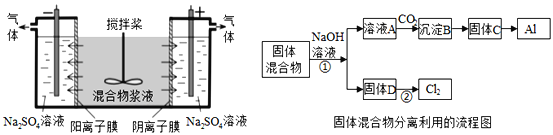
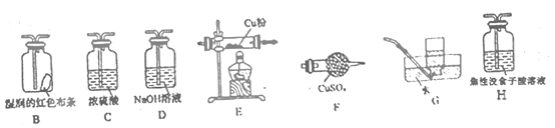
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
①写出高氯酸铵分解的化学方程式________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→________(填装置对应的字母),证明氧气存在的实验现象为________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为________。
【答案】复分解反应 重结晶 0℃冷水 2NH4ClO4 ![]() N2↑+Cl2↑+2O2↑+4H2O↑ F→B→D→C→E→H→G 装置E硬质玻璃管中红色粉末变为黑色 Mg3N2+6H2O=3Mg(OH)2+2NH3↑
N2↑+Cl2↑+2O2↑+4H2O↑ F→B→D→C→E→H→G 装置E硬质玻璃管中红色粉末变为黑色 Mg3N2+6H2O=3Mg(OH)2+2NH3↑
【解析】
(1)高氯酸钠与氯化铵反应生成高氯酸铵,化合价未变;
(2)由粗产品获得纯净的高氯酸铵操作属于晶体的提纯;
(3)NH4ClO4的溶解度随温度的升高而增大;
(4)①结合原子个数守恒进行配平;
②用无水CuSO4固体(F)检验H2O(g),再用湿润的红色布条(F)检验Cl2;对O2的检验应用O2将铜氧化的性质,由于Cl2同样具有氧化性,因此需先用NaOH溶液(D)除去Cl2,再通过浓硫酸(C)干燥,气体通过Cu粉(E)检验O2;G装置排水集气法用于检验N2,由于O2也难溶于水,因此需先用焦性没食子酸(H)吸收O2;
③Mg能与N2反应生成Mg3N2,Mg3N2与水反应生成的使湿润的红色石蕊试纸变蓝的气体为NH3。
(1)由流程可知,高氯酸钠与氯化铵反应生成高氯酸铵,则化学方程式为:NaClO4+NH4Cl=NH4ClO4+NaCl,该反应为复分解反应;
(2)由粗产品获得纯净的高氯酸铵操作属于晶体的提纯,而晶体的提纯用重结晶;
(3)由图2可知,NH4ClO4的溶解度随温度的升高而增大,因此洗涤NH4ClO4粗产品时,应选用0℃冷水进行洗涤,防止NH4ClO4溶解损耗;
(4)①由题干可知,NH4ClO4分解产生N2、Cl2和H2O,结合原子个数守恒可得,反应过程中还生成O2,因此该反应的化学方程式为:2NH4ClO4![]() N2↑+Cl2↑+2O2↑+4H2O↑;
N2↑+Cl2↑+2O2↑+4H2O↑;
②对产生气体的检验时,应首先用无水CuSO4固体(F)检验H2O(g),再用湿润的红色布条(F)检验Cl2;对O2的检验应用O2将铜氧化的性质,由于Cl2同样具有氧化性,因此需先用NaOH溶液(D)除去Cl2,再通过浓硫酸(C)干燥,气体通过Cu粉(E)检验O2;G装置排水集气法用于检验N2,由于O2也难溶于水,因此需先用焦性没食子酸(H)吸收O2,因此装置的连接顺序为:A→F→B→D→C→E→H→G;证明O2存在的实验现象为:E中红色粉末变为黑色;
③水反应生成的使湿润的红色石蕊试纸变蓝的气体为NH3,因此反应的化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
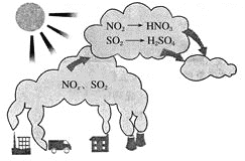
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤