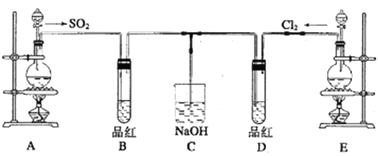
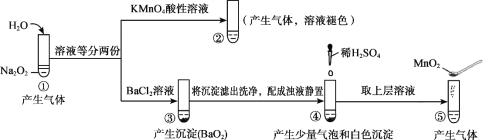
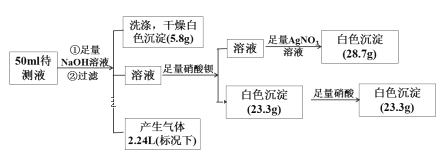
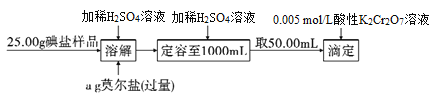
��Ŀ����
����Ŀ��һ������Һ̬������XY2����һ������������ǡ����ȫȼ�գ��仯ѧ����ʽ��XY2(l)��3O2(g)![]() XO2(g)��2YO2(g)����ȴ���ڱ�״���²��������������672mL���ܶ���2.56 g��L��1��
XO2(g)��2YO2(g)����ȴ���ڱ�״���²��������������672mL���ܶ���2.56 g��L��1��
��1����Ӧǰ�����������__________��
��2��������XY2��Ħ��������__________��
��3����XY2������X��Y��Ԫ��Ħ����������3��16����X��Y��Ԫ�طֱ�Ϊ__________��__________(��Ԫ�ط���)��
���𰸡�672mL 76g/mol C S
��������
(1)���ݷ���ʽ��֪������ʽ�Ⱥ����ߵ����������֮����ȣ����������������ʵ������ڷ�Ӧ��������������ʵ�����
(2)�������������غ㼰n=![]() ���㣻
���㣻
(3)����Ħ��������XY2������X��Y��Ԫ��Ħ����������3��16���㼴�ɡ�
(1)���ݷ���ʽ��֪������ʽ�Ⱥ����ߵ����������֮����ȣ����������������ʵ������ڷ�Ӧ��������������ʵ�������Ӧǰ�������״̬��ͬ����Ӧ������672mL�����壬�����ĵ����������ҲΪ672mL��
(2)��Ӧ���������=2.56g��L-1��0.672L=1.72g���������������غ㣬������XY2������Ϊ1.72-![]() ��32=0.76g�����ݷ���ʽ��֪XY2�����ʵ���Ϊ������
��32=0.76g�����ݷ���ʽ��֪XY2�����ʵ���Ϊ������![]() ��n(O2)=
��n(O2)=![]() =0.03mol��M(XY2)=
=0.03mol��M(XY2)=![]() =
=![]() =76g/mol��
=76g/mol��
(3)��XY2������X��Y��Ԫ��Ħ����������3��16����X��Ħ������=76��![]() =12g/mol��ΪC��Y��Ħ������=(76-12)��2=32g/mol��ΪS��
=12g/mol��ΪC��Y��Ħ������=(76-12)��2=32g/mol��ΪS��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�