题目内容
【题目】草酸(H2C2O4)又叫乙二酸,广泛存在于植物源食品中,25℃时,其解离常数Kal=5.9×10-2; Ka2= 6.4×10-5。下列与草酸有关的说法错误的是
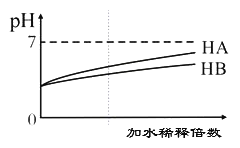
A.H2C2O4(aq) H+(aq) +HC2O4-(aq) △H >0;升温有利于提高草酸的电离程度
B.草酸中的碳为+3价,具有较强的还原性,可使酸性高锰酸钾溶液褪色
C.25℃时,KHC2O4溶液呈弱酸性,有时用于清洗金属表面的锈迹
D.同浓度的KHC2O4和K2C2O4混合溶液中:2c( H2C2O4) +2c( HC2O4)+2c( C2O42-) =3c(K+)
【答案】D
【解析】
A.升高温度,电离平衡正向进行,有利于提高草酸的电离度,A选项正确;
B.草酸中氢元素为+1价,氧元素为-2价,所以碳元素为+3价,具有较强的还原性,可以与高锰酸钾反应使其褪色,B选项正确;
C.25℃时,HC2O4-的水解平衡常数Kh=![]() =
=![]() =1.7×10-13< Ka2,草酸氢根的电离程度大于水解程度,所以其呈弱酸性,可以用来清洗金属表面的锈迹,C选项正确;
=1.7×10-13< Ka2,草酸氢根的电离程度大于水解程度,所以其呈弱酸性,可以用来清洗金属表面的锈迹,C选项正确;
D.根据物料守恒有,同浓度的KHC2O4和K2C2O4混合溶液中:3c(H2C2O4)+3c(HC2O4)+3c(C2O42-)=2c(K+),D选项错误;
答案选D。

【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol·L-1浓盐酸混合 | 溶液呈浅棕色,有刺激泩气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol·L-1稀盐酸混合物 | 无明显现象 |
①已知MnO2呈弱碱性。Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程是________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是________ 。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是________。
④用下图装置(a、b均为石墨电极)进行实验V:

i. K闭合时,指针向左偏转
ⅱ. 向右管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针偏转幅度变化不大ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol·L-1,指针向左偏转幅度增大
将i和ⅱ、ⅲ作对比,得出的结论是________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | …… |
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是________。
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、________有关。