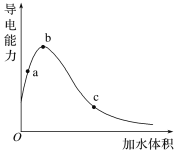
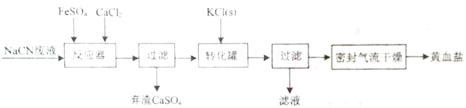
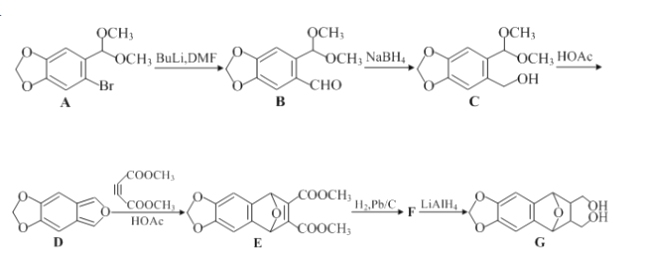
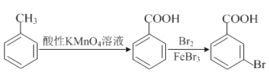
【题目】下列选项中的原因或结论与现象不对应的是
选项 | 现象 | 原因或结论 |
A | 在H2O2中加入MnO2,能加速H2O2的分解速率 | MnO2降低了反应所需的活化能 |
B | 将盛有NO2气体的密闭容器浸泡在热水中,容器内气体颜色变深 | 2NO2(g) |
C | 在密闭容器中有反应:A+xB(g) | A为非气体、x=1 |
D | 向5mL 0.005mol·L-1FeCl3溶液中加入5mL 0.015mol·L-1 KSCN溶液,溶液呈红色,再滴加几滴1mol·L-1 KSCN溶液,溶液颜色加深 | 增大反应物浓度,平衡向正反应方向移动 |
A. A B. B C. C D. D
【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2