题目内容
【题目】一块表面已部分被氧化、质量为0.77 g的钠放入10 g水中后,收集到氢气0.02 g。
(1)金属钠表面氧化钠的质量是________。
(2)所得溶液里溶质的质量分数是________。
【答案】0.31 g 11.2%
【解析】
(1)根据2Na+2H2O=2NaOH+H2↑计算金属钠的质量,从而计算出被氧化的钠的质量;
(2)根据n=![]() 计算出Na和Na2O的物质的量,根据Na元素守恒计算NaOH的质量,进一步计算溶液中溶质的质量分数。
计算出Na和Na2O的物质的量,根据Na元素守恒计算NaOH的质量,进一步计算溶液中溶质的质量分数。
(1)2Na + 2H2O = 2NaOH + H2↑
![]()
![]()
![]() ,解得m(Na)=0.46g,那么氧化钠的质量=0.77g-0.46g=0.31g;
,解得m(Na)=0.46g,那么氧化钠的质量=0.77g-0.46g=0.31g;
(2)混合物n(Na)=0.02mol,n(Na2O)=![]() =0.005mol,与水反应生成的NaOH的物质的量为0.02mol+0.01mol=0.03mol,质量为0.03mol×40g/mol=1.2g,由于生成的H2的质量为0.02g,因此所得的溶液的质量为10+0.77-0.02=10.75g,那么溶质的质量分数为
=0.005mol,与水反应生成的NaOH的物质的量为0.02mol+0.01mol=0.03mol,质量为0.03mol×40g/mol=1.2g,由于生成的H2的质量为0.02g,因此所得的溶液的质量为10+0.77-0.02=10.75g,那么溶质的质量分数为![]() ×100%=11.2%。
×100%=11.2%。

 目标测试系列答案
目标测试系列答案【题目】N2O5是一种新型硝化剂,一定温度下发生2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
4NO2(g)+O2(g) ΔH>0,T1温度下的部分实验数据为
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)mol/L | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )
A. 500 s内N2O5分解速率为2.96×10-3 mol/(L·s)
B. T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C. 其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol/L,则T1<T2
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1>K2
【题目】将一定量的SO2(g)和O2(g)分别通入体积为2L的恒容密闭容器中,在不同温度下进行反应,得到如下表中的两组数据:已知2SO2(g)+ O2(g) ![]() 2SO3(g) △H<0
2SO3(g) △H<0
实验 编号 | 温度/℃ | 平衡常数 | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
SO2 | O2 | SO2 | O2 | ||||
1 | T1 | K1 | 4 | 2 | x | 0.8 | 6 |
2 | T2 | K2 | 4 | 2 | 0.4 | y | t |
下列说法中不正确的是( )
A. x=2.4
B. 实验1在前6 min的反应速率v(SO2)=0.2 mol·L-1·min-1
C. K1、K2的关系:K2>K1
D. T1、T2的关系:T1>T2
【题目】利用如图所示装置测定中和热的实验步骤如下:
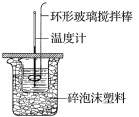
①用量筒量取50mL0.50mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50mL0.55mol·L-1NaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。回答下列问题:
(1)使盐酸与NaOH溶液混合均匀的正确操作是___(填字母)。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(2)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1L1mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为___。
(3)假设盐酸和氢氧化钠溶液的密度都是1g·cm-3,又知中和反应后生成溶液的比热容c=4.18J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=___(结果保留一位小数)。
(4)____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是__。