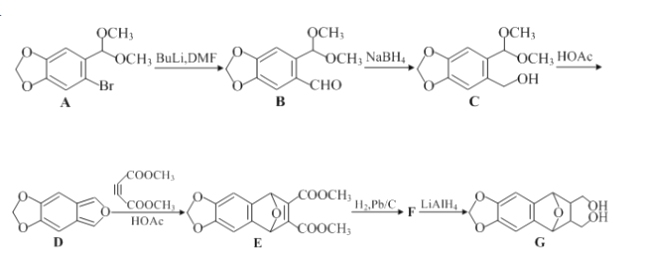
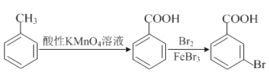
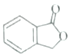
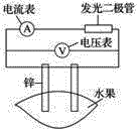
题目内容
【题目】一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
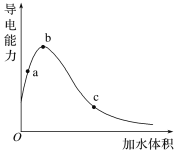
A. a、b、c三点溶液的pH:c<a<b
B. a、b、c三点CH3COOH的电离程度:c<a<b
C. 用湿润的pH试纸测量a处溶液的pH,测量结果偏小
D. a、b、c三点溶液用1 mol·L-1NaOH溶液中和,消耗NaOH溶液体积:c<a<b
【答案】C
【解析】
A.导电能力越强,离子浓度越大,氢离子浓度越大,pH越小,则a、b、c三点溶液的pH为b<a<c,选项A错误;
B.随水的增多,醋酸的电离程度在增大,所以a、b、c三点醋酸的电离程度:a<b<c,选项B错误;
C.用湿润的pH试纸测量a处溶液的pH,相当于对a点溶液稀释,氢离子浓度增大,pH偏小,选项C正确;
D.a、b、c三点溶液浓度不同,但溶质的物质的量相同,所以a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a=b=c,选项D错误;
答案选C。

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案【题目】下列表格中的各种情况,可以用对应选项中的图像表示的是
选项 | 反应 | 甲 | 乙 |
A | 外形、大小相近的金属和水反应 | Na | K |
B | 4mL0.01mol·L-1 KMnO4溶液分别和不同浓度的2mLH2C2O4(草酸)溶液反应 | 0.1mol·L-1的H2C2O4溶液 | 0.2mol·L-1的H2C2O4溶液 |
C | 5mL0.1mol·L-1Na2S2O3溶液和5mL0.1mol·L-1H2SO4溶液反应 | 热水 | 冷水 |
D | 5mL4%的过氧化氢溶液分解放出O2 | 无MnO2粉末 | 加MnO2粉末 |
A.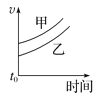 B.
B.
C. D.
D.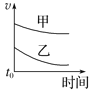
【题目】大气中的部分碘源于O3对海水中I-的氧化。某科学小组进行O3与含I-溶液反应相关研究。
(1)O3将I-氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)![]() IO-(aq)+O2(g) ΔH1
IO-(aq)+O2(g) ΔH1
②IO-(aq)+H+(aq)![]() HIO(aq) ΔH2
HIO(aq) ΔH2
③HIO(aq)+I-(aq)+H+(aq)![]() I2(aq)+H2O(l) ΔH3
I2(aq)+H2O(l) ΔH3
用热化学方程式表示O3氧化I-生成I2的反应___。
(2)O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216mol·L-1。
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 35 | 15 | 7 |
①在30℃、pH=4.0条件下,O3的分解速率为___mol·L-1·min-1。
②pH增大能加速O3分解,表明对O3分解起催化作用的是____。
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为___(填字母)。
a.40℃、pH=3.0 b.10℃、pH=4.0 c.30℃、pH=7.0