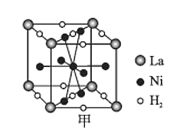
【题目】肼(N2H4)是一种应用广泛的化工原料。工业上先合成氨气:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0,再进一步制备肼。完成下列填空:
2NH3(g)ΔH<0,再进一步制备肼。完成下列填空:
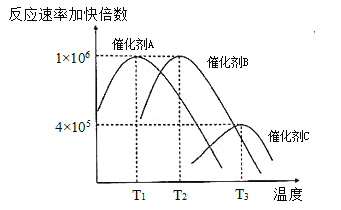
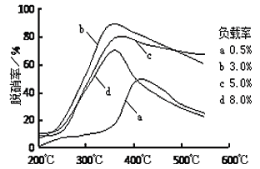
(1)合成氨需要选择合适的催化剂,分别选用A、B、C三种催化剂进行试验,所得结果如图所示(其他条件相同),则生产中适宜选择的催化剂是__(填“A”或“B”或“C”),理由是:__。
(2)一定条件下,对在密闭容器中进行的合成氨反应达平衡后,其他条件不变时,若同时压缩容器的体积和升高温度达新平衡后,与原平衡相比,请将有关物理量的变化的情况填入下表中(填“增大”、“减小”或“无法确定”)
反应速率 | 平衡常数K | |
变化情况 | ____ | ____ |
(3)通常把拆开1mol某化学键所吸收的能量看成该化学键的键能。已知部分化学键的键能如下:
化学键 | N—H | N—N | O==O | N≡N | O—H |
键能(kJ/mol) | 386 | 167 | 498 | 946 | 460 |
发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态)。该反应的热化学方程式为:____。
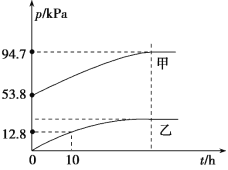
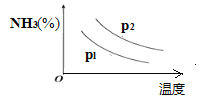
(4)氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,己知初始时n(N2):n(H2)=1:3。判断pl、p2压强的大小关系,pl___p2(选填“>”、“<”或“=”)。
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量__;充入氦气,混合气体的密度__(填“增大”“减小”或“不变”)。
(2)830℃,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
①写出CH3COOH的电离方程式____,其电离平衡常数表达式K a=___;
②根据表中数据判断,浓度均为0.01mol·L-1的下列三种物质的溶液中,酸性最强的是___(填编号);将下列各溶液分别稀释100倍,pH变化最小的是___(填编号)。
A.CH3COOH B.H2CO3 C.H2SO3