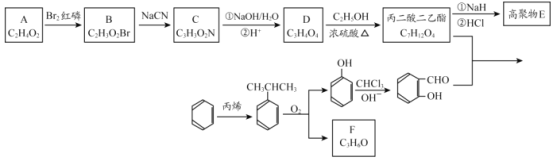
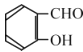
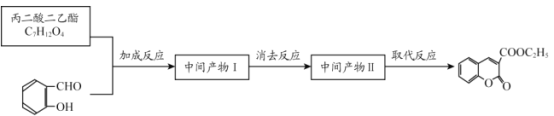
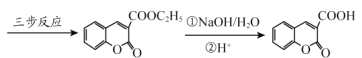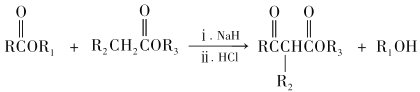题目内容
【题目】李克强总理曾在国务院政府工作报告中强调二氧化硫、氮氧化物排放量要下降3%。因此,研究烟气的脱硝(除NOx)、脱硫(除SO2)技术有着积极的环保意义。
(1)汽车的排气管上安装“催化转化器”,其反应的热化学方程式为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH=-746.50 kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,若温度和体积不变,反应过程中(0~15 min)NO的物质的量随时间变化如图。
2CO2(g)+N2(g) ΔH=-746.50 kJ·mol-1。T℃时,将等物质的量的NO和CO充入容积为2 L的密闭容器中,若温度和体积不变,反应过程中(0~15 min)NO的物质的量随时间变化如图。

①图中a、b分别表示在相同温度下,使用质量相同但表面积不同的催化剂时,达到平衡过程中n(NO)的变化曲线,其中表示催化剂表面积较大的曲线是_____(填“a”或“b”)。
②T℃时,15 min时,再向容器中充入CO、CO2各0.2 mol,则平衡将____移动(填“向左”、“向右”或“不”)。
(2)在催化剂作用下,用还原剂[如肼(N2H4)]选择性地与NOx反应生成N2和H2O。
已知200℃时:Ⅰ.3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9 kJ·mol-1;
II.N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8 kJ·mol-1。
①写出肼的电子式______。
②200℃时,肼分解成氮气和氢气的热化学方程式为_______。
③目前,科学家正在研究一种以乙烯作为还原剂的脱硝原理,其脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图所示。
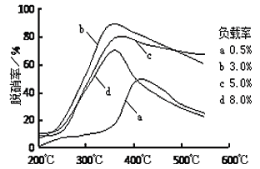
为达到最佳脱硝效果,应采取的条件是_______。
(3)某温度下,N2O5气体在一体积固定的容器中发生如下反应:2N2O5(g)=4NO2(g)+O2(g)(慢反应)△H<0,2NO2(g)![]() N2O4(g)(快反应)△H<0,体系的总压强p总和pO2随时间的变化如图所示:
N2O4(g)(快反应)△H<0,体系的总压强p总和pO2随时间的变化如图所示:
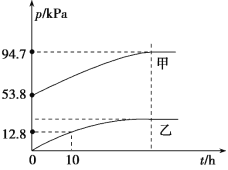
①图中表示O2压强变化的曲线是_______(填“甲”或“乙”)。
②已知N2O5分解的反应速率v=0.12pN2O5(kPah-1),t=10 h时,pN2O5=__kPa,v=__kPah-1(结果保留两位小数,下同)。
③该温度下2NO2![]() N2O4反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
N2O4反应的平衡常数Kp=___kPa-1(Kp为以分压表示的平衡常数)。
【答案】b 不 ![]() N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1 350℃左右、负载率3% 乙 28.2 3.38 0.05
N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1 350℃左右、负载率3% 乙 28.2 3.38 0.05
【解析】
(1)①催化剂表面积越大,反应速率越快,达到平衡所需要的时间越短;
②起始时,NO为4 mol,平衡时NO为0.2 mol,根据方程式求出平衡时CO、CO2、N2的浓度,根据平衡常数表达式计算;根据Qc与K的相对大小分析;
(2)①肼分子式是N2H4,结构简式是H2N-NH2,据此书写电子式;
②N2H4分解产生N2(g)、H2(g),将已知热化学方程式叠加,可得肼分解的热化学方程式;
③根据温度与脱硝率、负载率关系判断最佳反应条件;
(3)①图乙中表示O2压强变化的曲线是乙,甲为总压强p总;
②图甲表示总压强p总,反应起始只有N2O5气体,则起始pN2O5=53.8 kPa,根据图可知,t=10 h时,pO2=12.8 kPa,根据反应2N2O5(g)![]() 4NO2(g)+O2(g),则该时间段N2O5的压强减少为12.8 kPa×2=25.6 kPa,据此计算;
4NO2(g)+O2(g),则该时间段N2O5的压强减少为12.8 kPa×2=25.6 kPa,据此计算;
③根据反应2N2O5(g)![]() 4NO2(g)+O2(g)计算N2O5完全分解时的压强计算出NO2和O2的压强,再根据2NO2(g)
4NO2(g)+O2(g)计算N2O5完全分解时的压强计算出NO2和O2的压强,再根据2NO2(g)![]() N2O4(g)计算平衡时的NO2、N2O4压强,可得平衡常数。
N2O4(g)计算平衡时的NO2、N2O4压强,可得平衡常数。
(1)由于催化剂表面积越大,反应速率越快,达到平衡所需要的时间越短,根据图象b曲线表示的反应条件先达到平衡先达到,说明b反应速率快,则b催化剂反应速率快,则b的表面积比催化剂a大;
②在恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g),反应开始时,n(CO)=n(NO)=0.4 mol,n(CO2)=n(N2)=0,反应达到平衡时n(NO)=0.2 mol,则根据物质反应转化关系可知,n(CO)=0.2 mol,n(CO2)=0.2 mol,n(N2)=0.1 mol,由于容器的容积是2 L,所以各种物质的平衡浓度:c(CO)=c(NO)=0.1 mol/L,c(CO2)=0.1 mol/L,c(N2)=0.05 mol/L,则平衡常数K=
2CO2(g)+N2(g),反应开始时,n(CO)=n(NO)=0.4 mol,n(CO2)=n(N2)=0,反应达到平衡时n(NO)=0.2 mol,则根据物质反应转化关系可知,n(CO)=0.2 mol,n(CO2)=0.2 mol,n(N2)=0.1 mol,由于容器的容积是2 L,所以各种物质的平衡浓度:c(CO)=c(NO)=0.1 mol/L,c(CO2)=0.1 mol/L,c(N2)=0.05 mol/L,则平衡常数K=![]() =5,若平衡时温度不变,再向容器中从容CO、CO2各0.2 mol,则c(CO)=c(CO2)=0.2 mol/L,Qc=
=5,若平衡时温度不变,再向容器中从容CO、CO2各0.2 mol,则c(CO)=c(CO2)=0.2 mol/L,Qc=![]() =5=K,所以化学平衡不发生移动;
=5=K,所以化学平衡不发生移动;
(2)①肼分子式是N2H4,结构简式是H2N-NH2,2个N原子之间形成1个共价键,每个N原子再分别与2个H原子形成2个共价键,使分子中每个原子都达到稳定结构,故其电子式为:![]() ;
;
②已知:(I)3N2H4(g)=N2(g)+4NH3(g) ΔH1=-32.9kJ·mol-1;
(II)N2H4(g)+H2(g)=2NH3(g) ΔH2=-41.8 kJ·mol-1。
将(I)- (II)×2,整理可得N2H4(g)=N2(g)+2H2(g) ΔH=+50.7 kJ·mol-1;
③根据温度与脱硝率、负载率的关系可知:要达到最佳脱硝效果,应采取的条件是温度350℃左右、负载率3%;
(3)①反应从加入
②图甲表示总压强p总,反应起始只有N2O5气体,则起始pN2O5=53.8 kPa,根据图可知,t=10 h时,pO2=12.8 kPa,根据反应2N2O5(g)![]() 4NO2(g)+O2(g),有物质之间反应转化关系可知该时间段N2O5的压强减少△p(N2O5)=12.8 kPa×2=25.6 kPa,故t=10 h时,pN2O5=53.8 kPa-25.6 kPa=28.2 kPa,v(N2O5)=0.12pN2O5(kPah-1)=0.12×28.2 kPa=3.38 kPah-1;
4NO2(g)+O2(g),有物质之间反应转化关系可知该时间段N2O5的压强减少△p(N2O5)=12.8 kPa×2=25.6 kPa,故t=10 h时,pN2O5=53.8 kPa-25.6 kPa=28.2 kPa,v(N2O5)=0.12pN2O5(kPah-1)=0.12×28.2 kPa=3.38 kPah-1;
③已知:起始时pN2O5=53.8 kPa,根据反应2N2O5(g)![]() 4NO2(g)+O2(g),若N2O5完全分解,生成的pNO2=53.8 kPa×2=107.6 kPa,pO2=53.8 kPa÷2=26.9 kPa,则此时气体总压强应该为p(总)=107.6 kPa+26.9 kPa=134.5 kPa。但根据图示可知,最终压强为94.7 kPa,则NO2转化发生反应:2NO2(g)
4NO2(g)+O2(g),若N2O5完全分解,生成的pNO2=53.8 kPa×2=107.6 kPa,pO2=53.8 kPa÷2=26.9 kPa,则此时气体总压强应该为p(总)=107.6 kPa+26.9 kPa=134.5 kPa。但根据图示可知,最终压强为94.7 kPa,则NO2转化发生反应:2NO2(g)![]() N2O4(g)使压强减少了134.5 kPa-94.7 kPa=39.8 kPa,根据反应:2NO2(g)
N2O4(g)使压强减少了134.5 kPa-94.7 kPa=39.8 kPa,根据反应:2NO2(g)![]() N2O4(g),△p=pN2O4=39.8 kPa,则平衡时pNO2=107.6 kPa-2×39.8 kPa=28 kPa,则该反应的平衡常数Kp=
N2O4(g),△p=pN2O4=39.8 kPa,则平衡时pNO2=107.6 kPa-2×39.8 kPa=28 kPa,则该反应的平衡常数Kp=![]() =0.05 kPa-1。
=0.05 kPa-1。

 黄冈创优卷系列答案
黄冈创优卷系列答案【题目】二苯甲酮广泛应用于药物合成,同时也是有机颜料、杀虫剂等的重要中间体。实验室以苯与苯甲酰氯为原料,在AlCl3作用下制备二苯甲酮的实验流程如下图所示:

相关物理常数和物理性质如下表:
名称 | 相对分 子质量 | 密度/g·cm-3 | 熔点/oC | 沸点/oC | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶水,易溶乙醇 |
苯甲酰氯 | 140.5 | 1.22 | 1 | 197 | 遇水分解 |
无水氯化铝 | 133.5 | 2.44 | 190 | 178(升华) | 遇水水解,微溶苯 |
二苯甲酮 | 182 | 1.11 | 48.5 | 305(常压) | 难溶水,易溶苯 |
已知:反应原理为: 。该反应剧烈放热。
。该反应剧烈放热。
回答下列问题:
(1)反应装置如图所示(加热和夹持装置已略去),迅速称取7.5 g无水三氯化铝放入三颈瓶中,再加入30 mL无水苯,搅拌,缓慢滴加6 mL新蒸馏过的苯甲酰氯。反应液由无色变为黄色,三氯化铝逐渐溶解。混合完后,保持50℃左右反应1.5~2 h。
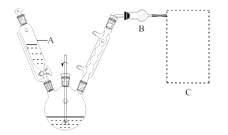
仪器A的名称为_______。装置B作用为_______。缓慢滴加苯甲酰氯的原因是______。能作为C中装置的是_______(填标号)。

(2)操作X为___________。
(3)NaOH溶液洗涤的目的是_____________。
(4)粗产品先经常压蒸馏除去__________,再减压蒸馏得到产品。
(5)当所测产品熔点为________时可确定产品为纯品。已知实验最终所得纯品8.0 g,则实验产率为_________ %(保留三位有效数字)。
【题目】I.下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
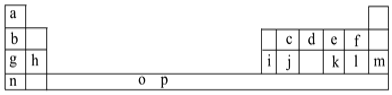
试回答下列问题:
(1)元素p为26号元素,请写出其基态原子电子排布式:___。
(2)d与a反应的产物的分子中中心原子的杂化形式为___,该分子是___(填“极性”或“非极性”)分子。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:__。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/kJ·mol-1 | I1 | 717 | 759 |
I2 | 1509 | 1561 | |
I3 | 3248 | 2957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___。
II.(1)基态硫原子中,核外占据最高能级电子的电子云轮廓图形状为__。硫的一种同素异形体分子式为S8,其结构如图所示,其中S原子的杂化轨道类型为___。S8易溶于二硫化碳的原因是___。
![]()
(2)教材插图具有简洁而又内涵丰富的特点。请回答以下问题:
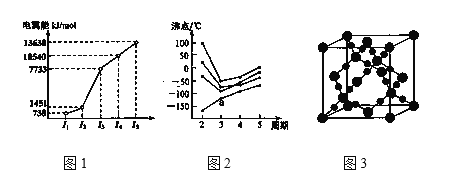
①第三周期的某主族元素,其第一至第五电离能数据如图1所示,则该元素对应的原子有___种不同运动状态的电子。
②CO2在高温高压下所形成的晶体其晶胞如图3所示。则该晶体的类型属于___晶体。
③如图2所示,每条折线表示周期表ⅣA到ⅦA 中的某一族元素氢化物的沸点变化。每个小黑点代表一种氢化物,其中a点代表的是__。判断依据___。
【题目】2020年5月1日北京市在全市范围内开展施行垃圾分类,下列垃圾分类不正确是( )
A.鱼骨、菜叶 | B.消毒剂及其包装物 | C.破损的易拉罐 | D.破碎玻璃 |
|
|
|
|
厨余垃圾 | 有害垃圾 | 可回收垃圾 | 其他垃圾 |
A.AB.BC.CD.D