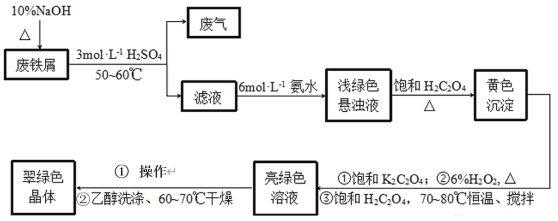
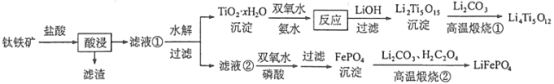
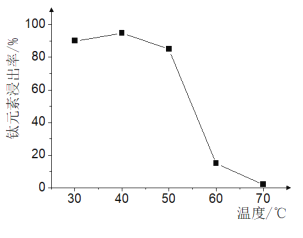
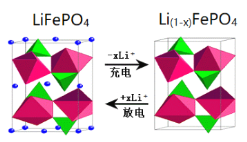
��Ŀ����
����Ŀ����֪��ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ���������������ԭ������ش��������⣺
��1�����淴ӦFeO(s)��CO(g)![]() Fe(s)��CO2(g)��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
Fe(s)��CO2(g)��������ҵ��һ����Ҫ��Ӧ�����¶���ƽ�ⳣ��K�Ĺ�ϵ���±���
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
���÷�Ӧ������̶����ܱ������н��У���һ�������´ﵽƽ��״̬���������¶ȣ���������ƽ����Է�������__�����뺤�������������ܶ�__(��������������С������������)��
��2��830�棬��ӦCO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)��ƽ�ⳣ��K=1����2L���ݷ�Ӧ���з���������Ӧ���ֱ����3molCO2��2molH2��1molCH3OH��4molH2O(g)����Ӧ��__������С�������������桱���ƶ�����
CH3OH(g)��H2O(g)��ƽ�ⳣ��K=1����2L���ݷ�Ӧ���з���������Ӧ���ֱ����3molCO2��2molH2��1molCH3OH��4molH2O(g)����Ӧ��__������С�������������桱���ƶ�����
��3��25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
��ѧʽ | CH3COOH | NH3��H2O | H2CO3 | H2SO3 |
����ƽ�ⳣ�� | 1.7��10-5 | 1.7��10-5 | K1��4.3��10-7 K2��5.6��10-11 | K1��1.3��10-2 K2��6.3��10-8 |
��д��CH3COOH�ĵ��뷽��ʽ____�������ƽ�ⳣ������ʽK a=___��
�ڸ��ݱ��������жϣ�Ũ�Ⱦ�Ϊ0.01mol��L-1�������������ʵ���Һ�У�������ǿ����___(����)�������и���Һ�ֱ�ϡ��100����pH�仯��С����___(����)��
A��CH3COOH B��H2CO3 C��H2SO3
���𰸡���С ���� �� CH3COOH ![]() H++CH3COO-
H++CH3COO- 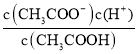 C B
C B
��������
(1)���ݱ������ݿ�֪�������¶ȣ�ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ����ݴ˷������
(2)���ȼ���c(CO2)��c(H2)��c(CH3OH)��c(H2O)���ټ���Ũ���̣���K�ȽϺ��жϷ�Ӧ�ķ���
(3)��CH3COOHΪ���ᣬ�ݴ���д���뷽��ʽ�������ݵ��뷽��ʽ��д����ƽ�ⳣ������ʽ����KԽ������Խǿ������Խǿ��ϡ��100����pH�仯Խ�ݴ˷������
(1)�����¶ȣ�ƽ�ⳣ����С��˵��ƽ�����淴Ӧ�����ƶ��������������С�����ʵ������䣬��������ƽ����Է���������С�����뺤������Ӧ������䣬�������������������ܶ����ʴ�Ϊ����С������
(2)c(CO2)=![]() =1.5mol/L��c(H2)=
=1.5mol/L��c(H2)=![]() =1mol/L��c(CH3OH)=
=1mol/L��c(CH3OH)=![]() =0.5mol/L ��c(H2O)=
=0.5mol/L ��c(H2O)=![]() =2mol/L����Ũ����=
=2mol/L����Ũ����=![]() =
=![]() ��K=1����Ӧ������У��ʴ�Ϊ������
��K=1����Ӧ������У��ʴ�Ϊ������
(3)��CH3COOHΪ���ᣬ���뷽��ʽΪCH3COOH ![]() H++CH3COO-������ƽ�ⳣ������ʽK a=
H++CH3COO-������ƽ�ⳣ������ʽK a=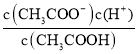 ���ʴ�Ϊ��CH3COOH
���ʴ�Ϊ��CH3COOH ![]() H++CH3COO-��
H++CH3COO-��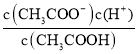 ��
��
��KԽ��ʾ����̶�Խ������Խǿ�����ݱ������ݿ�֪��H2SO3��K1������H2SO3������ǿ������Խǿ��ϡ��100����pH�仯Խ����pH�仯��С��������������H2CO3���ʴ�Ϊ��C��B��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��(1)��֪��Ӧ2HI(g)=H2(g)+I2(g)�ġ�H=+11kJ��mol-1��1molH2(g)��1molI2(g)�����л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1molHI(g)�����л�ѧ������ʱ�����յ�����Ϊ______________kJ��
(2)��֪ij�ܱ������д�������ƽ�⣺CO(g)+H2O(g)![]() CO2(g)+H2(g)��CO��ƽ�����ʵ���Ũ��c(CO)���¶�T�Ĺ�ϵ��ͼ��ʾ��
CO2(g)+H2(g)��CO��ƽ�����ʵ���Ũ��c(CO)���¶�T�Ĺ�ϵ��ͼ��ʾ��
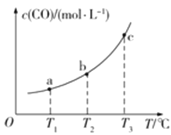
�ٸ÷�Ӧ��H_____________0(����������������)
����T1��T2ʱ��ƽ�ⳣ���ֱ�ΪK1��K2����K1_____________K2(��������������������=��)��
(3)�ں����ܱ������У�����������MoS2��O2����������Ӧ��2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)��H�����������ƽ��ת��������ʼѹǿ���¶ȵĹ�ϵ��ͼ��ʾ��
2MoO3(s)+4SO2(g)��H�����������ƽ��ת��������ʼѹǿ���¶ȵĹ�ϵ��ͼ��ʾ��
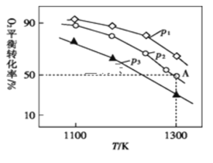
��p1��p2��p3�Ĵ�С��___________��
������ʼʱͨ��7.0molO2��p2Ϊ7.0kPa����A��ƽ�ⳣ��Kp=___________(������ƽ���ѹ��������ƽ��Ũ�ȼ��㣬��ѹ=��ѹ����������ʵ���������д������ʽ����)��
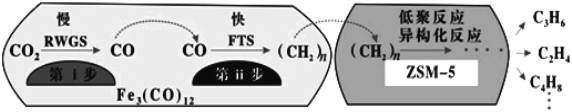
(4)�п�Ժ���ݻ�ѧ�����о�����Fe3(CO)12/ZSM-5��CO2����ϳɵ�̼ϩ����Ӧ�����ò��ﺬCH4��C3H6��C4H8�ȸ������Ӧ������ͼ��
����������Na��K��Cu������(����Ҳ�������)�ɸı䷴Ӧ��ѡ���ԣ�������������ͬʱ�����Ӳ�ͬ������������ͬʱ�����CO2ת���ʺ���������ʵ������������
���� | CO2ת����(%) | �����������в����е�ռ��(%) | ||
C2H4 | C3H6 | ���� | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
������ߵ�λʱ������ϩ�IJ�������Fe3(CO)12/ZSM-5������_______����Ч����ã�������������ߵ�λʱ������ϩ�����ĸ���ԭ����:___________
������˵����ȷ����______��
a���������ķ�ӦΪ��CO2+H2![]() CO+H2O
CO+H2O
b����������Ӧ�Ļ�ܵ��ڵ�����
c������������Ҫ�ڵ;۷�Ӧ���칹����Ӧ����������
d��Fe3(CO)12/ZSM-5ʹCO2����ϳɵ�̼ϩ������H��С
e�����Ӳ�ͬ������Ӧ��ƽ�ⳣ��������ͬ