题目内容
【题目】下列说法正确的是___(填序号)。
①将1 mol NaCl溶解在1 L水中,可得1 mol·L-1NaCl的溶液
②将11.2 L HCl气体通入水配成0.5 L溶液,得到1 mol·L-1的盐酸
③1 L 10 mol·L-1的盐酸与9 L水混合,得到1 mol·L-1的盐酸
④将0.4 g NaOH溶解水中形成100 mL溶液,从中取出10 mL,所取溶液物质的量浓度为0.1 mol·L-1(不考虑溶液体积的变化)
⑤将1 mol Na2O溶于水配成1 L溶液,所得溶质的物质的量浓度为1 mol·L-1(不考虑溶液体积的变化)
【答案】④
【解析】
①溶液的体积不是1 L,故①错误;
②没有指明标准状况,无法计算HCl的物质的量,故②错误
③1 L 10 mol·L-1的盐酸与9 L水混合后溶液的体积无法计算,故③错误;
④将0.4 g NaOH物质的量![]() ,溶解在水中形成100 mL溶液,溶液的物质的量浓度
,溶解在水中形成100 mL溶液,溶液的物质的量浓度![]() ,从中取出10 mL,溶液物质的量浓度不变,还是0.1 mol·L-1,故④正确;
,从中取出10 mL,溶液物质的量浓度不变,还是0.1 mol·L-1,故④正确;
⑤将1 mol Na2O溶于水配成1 L溶液,Na2O+H2O = 2NaOH,溶质为氢氧化钠,物质的量为2mol,所得溶质的物质的量浓度为2 mol·L-1,故⑤错误。
综上所述,答案为④。

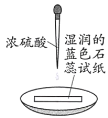
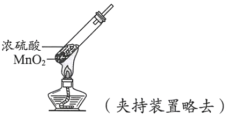
【题目】下列依据实验方案和现象对浓硫酸性质做出的判断合理的是
实验方案 | 实验I: | 实验II: |
实验现象 | 试纸中心区域变黑,边缘变红 | 黑色固体溶解,溶液接近无色(溶液中锰元素仅以 |
A.由I可知,浓硫酸具有脱水性B.由I可知,浓硫酸具有弱酸性
C.由II可知,浓硫酸具有强氧化性D.由II可知,浓硫酸具有吸水性
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
(1)可逆反应FeO(s)+CO(g)![]() Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
Fe(s)+CO2(g)是炼铁工业中一个重要反应,其温度与平衡常数K的关系如下表:
T/K | 938 | 1 100 |
K | 0.68 | 0.40 |
若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,若升高温度,混合气体的平均相对分子质量__;充入氦气,混合气体的密度__(填“增大”“减小”或“不变”)。
(2)830℃,反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
CH3OH(g)+H2O(g)的平衡常数K=1,在2L恒容反应器中发生上述反应,分别充入3molCO2、2molH2、1molCH3OH、4molH2O(g),反应向__方向进行。(填“正”、“逆”或“不移动”)
(3)25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
①写出CH3COOH的电离方程式____,其电离平衡常数表达式K a=___;
②根据表中数据判断,浓度均为0.01mol·L-1的下列三种物质的溶液中,酸性最强的是___(填编号);将下列各溶液分别稀释100倍,pH变化最小的是___(填编号)。
A.CH3COOH B.H2CO3 C.H2SO3
【题目】I.(1)对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由8 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
2SO3 , 如果2min内SO2的浓度由8 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是____________;b c过程中改变的条件可能是____________; 若增大压强时,反应速度变化情况画在c-d处__________.
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是____________;b c过程中改变的条件可能是____________; 若增大压强时,反应速度变化情况画在c-d处__________.
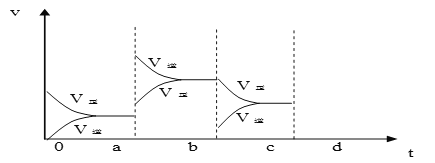
(3)对于下列电离平衡:NH3·H2O![]() NH4+ + OH -,能使c(NH4+)增大的措施是:_________
NH4+ + OH -,能使c(NH4+)增大的措施是:_________
①升高温度 ②加氨气 ③水 ④ NH4Cl溶液 ⑤NaOH溶液 ⑥适量的盐酸
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________;
(2)该反应为____________反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为____________℃;
(4)830℃时,向该容器中加入1LCO2与1LH2,平衡时CO2的体积分数是____________。