【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%
【题目】某小组研究Cu与浓硝酸反应时发现如下现象:
装置与试剂 | 现象 |
| Cu片完全溶解,产生红棕色气体,得到绿色溶液A,该溶液长时间放置后得到蓝色溶液B。反应后溶液体积几乎不变。 |
(1)Cu与浓硝酸反应的离子方程式为_____。
(2)甲同学猜测溶液A不是蓝色而呈绿色与溶解了NO2有关,于是向溶液B中通入NO2,然后再持续通入一段时间N2,观察到现象:_____,证实猜测合理。
甲同学为深入研究溶液A呈绿色的原因,查得如下资料并提出了新的假设:

假设一:A中形成了Cu(NO2)![]() 使溶液呈绿色。
使溶液呈绿色。
为了验证假设一的合理性,甲同学进行了如下实验:
(实验一)
操作 | 现象 |
①向20.0mL0.5mol·L-1Cu(NO3)2蓝色溶液中通入少量NO2气体 | 溶液呈绿色 |
②向20.0mL水中通入与①中等量的NO2气体 | 溶液呈无色 |
(3)操作②的目的是_____。
(4)乙同学向①所得溶液中滴加浓硫酸,使溶液中c(H+)达约8mol·L-1,观察到有无色气体放出(遇空气变为红棕色),溶液很快变回蓝色。利用平衡移动原理解释溶液变蓝的原因:_____。
(5)综合甲乙两位同学的实验,假设一不成立。请说明理由:______。
乙同学查得如下资料并提出来另一种假设:
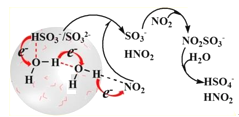
![]()
假设二:A中浓硝酸溶解了NO2所得黄色溶液与Cu2+的蓝色复合形成的绿色。
为验证假设二的合理性,乙同学进行了如下实验:
(实验二)
操作 | 现象 |
①配制与溶液A的c(H+)浓度相同的HNO3溶液,取20.0mL,通入少量NO2气体 | 溶液呈黄色 |
②加入 | 溶液变为绿色 |
③…… | 溶液立即变回蓝色 |
(6)操作②中加入的试剂为_____。
操作③进一步证明了假设二的合理性,写出该操作:span>_____。