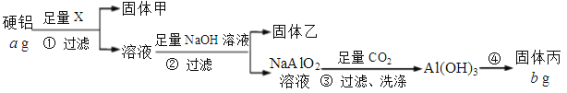
题目内容
【题目】“84消毒液”为含氯消毒剂的代表被广泛使用,化学小组用如下方法测定某“84消毒液”中有效氯的含量。
I.准确量取2.00mL消毒液稀释成100.0mL溶液;
II.取1.00mL上述稀释后溶液,依次加入3mol·L-1硫酸溶液15mL、15.00mL一定浓度的Fe2+溶液,加盖振摇混匀后,室温静置反应10min;
III.用0.0010mol·L-1的标准K2Cr2O7溶液滴定II中反应后溶液,记录消耗的体积为VmL;
IV.另取与II中相同的15.00mL一定浓度的Fe2+溶液,依次加入1.00mL蒸馏水、3mol·L-1硫酸溶液15mL,加盖振摇混匀;
V.用0.0010mol·L-1的标准K2Cr2O7溶液滴定IV中溶液,记录消耗的体积为V0mL。
(1)工业上制取“84消毒液”反应的化学方程式为_______。
(2)Ⅰ中稀释溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______。
(3)用KSCN溶液检测到II反应后溶液中含有Fe3+的现象是______,Ⅱ中反应的离子方程式为______。
(4)Ⅲ中发生反应的离子方程式是_____(Cr2O![]() 转化为Cr3+,此条件下不氧化Cl-)。
转化为Cr3+,此条件下不氧化Cl-)。
(5)该“84消毒液”中有效氯的含量为_____ g/100mL。(有效氯以NaClO质量计,NaClO摩尔质量:74.5g·mol-1)
(6)由于Fe2+具有_____性,II、IV中实验须在密闭容器中进行。
【答案】Cl2+2NaOH=NaCl+NaClO+H2O 100mL容量瓶 溶液变成血红色 2H++ClO-+2Fe2+=Cl-+2Fe3++H2O ![]() +6Fe2++14H+=6Fe3++2Cr3++7H2O 1.1175(V0-V)或1.1(V0-V) 还原
+6Fe2++14H+=6Fe3++2Cr3++7H2O 1.1175(V0-V)或1.1(V0-V) 还原
【解析】
结合工业用氯气和氢氧化钠制取“84消毒液”书写化学反应方程式,根据氧化还原反应规律书写Ⅱ、Ⅲ步骤中的离子反应方程式,结合方程式及关系式法进行相关计算。
(1)“84消毒液”的主要成分为NaClO,工业上用氯气和氢氧化钠制取,反应的化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(2)Ⅰ中稀释溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和100mL的容量瓶,故答案为:100mL的容量瓶;
(3)Fe3+遇到KSCNf发生反应Fe3++3SCN-=Fe(SCN)3,Fe(SCN)3为血红色,因此用KSCN溶液检测到II反应后溶液中含有Fe3+的现象是溶液变成血红色,反应Ⅱ中Fe2+被ClO-在酸性条件下氧化为Fe3+,反应的离子方程式为2H++ClO-+2Fe2+=Cl-+2Fe3++H2O,故答案为:溶液变成血红色;2H++ClO-+2Fe2+=Cl-+2Fe3++H2O;
(4)Ⅲ中剩下的Fe2+被K2Cr2O7氧化为Fe3+,Cr2O![]() 转化为Cr3+,此条件下不氧化Cl-,则反应的离子方程式为
转化为Cr3+,此条件下不氧化Cl-,则反应的离子方程式为![]() +6Fe2++14H+=6Fe3++2Cr3++7H2O,故答案为:
+6Fe2++14H+=6Fe3++2Cr3++7H2O,故答案为:![]() +6Fe2++14H+=6Fe3++2Cr3++7H2O;
+6Fe2++14H+=6Fe3++2Cr3++7H2O;
(5)由Ⅰ、Ⅱ、Ⅲ可知,消毒液中的ClO-氧化了部分Fe2+,剩余的Fe2+用K2Cr2O7标准溶液滴定,消耗体积为VmL。由IV、V可知,全部的Fe2+用K2Cr2O7标准溶液滴定,消耗体积为V0mL。所以被ClO-氧化的n(Fe2+)=6×10-3 mol·L-1×(V0-V)×10-3 L×102=6×10-4(V0-V)mol,根据(3)问中所写方程式,有2Fe2+~ClO-,所以n(NaClO)=3×10-4(V0-V)mol,故有效氯含量=74.5g·mol-1×3×10-4(V0-V) mol÷2 mL×100 mL=1.1175(V0-V)g≈1.1(V0-V),故答案为:1.1175(V0-V)或1.1(V0-V);
(6)由于Fe2+具有还原性,易被空气中的氧气氧化,因此II、IV中实验须在密闭容器中进行,故答案为:还原。

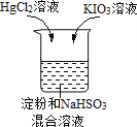
【题目】某同学进行如下趣味化学实验:
将HgCl2溶液和KIO3溶液同时加入 | 反应原理: ①IO ②IO ③Hg2++2I-=HgI2↓(橙红色) |
现象:先产生橙红色沉淀,几秒钟后溶液颜色变为蓝色 |
下列说法不正确的是( )
A.反应①中IO![]() 表现了氧化性
表现了氧化性
B.反应①对反应②的进行有促进作用
C.该实验条件下,反应速率:③>②
D.用Na2SO3溶液代替NaHSO3进行实验,现象相同
【题目】在l0℃时,10 mL 0.4 mol L-1H2O2溶液发生催化分解:2H2O2![]() 2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
2H2O+O2↑,不同时刻测得生成O2的体积(已折算为标准状况)如下表:
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
下列叙述不正确的是(溶液体积变化忽略不计)
A. 0~2 min的平均反应速率比4~6 min快
B. 0~6 min 的平均反应速率v(H2O2)=3.3×10-2 moL-1 L-1 min-1
C. 反应至 6 min 时,c(H2O2)=0.3 mol·L-1
D. 反应至6 min时,H2O2分解了50%