题目内容
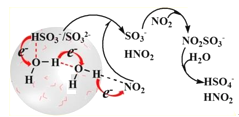
【题目】近年来,我国秋冬季雾霾天气呈现常态化趋势,造成严重空气污染,对人类身心健康造成极大威胁。硫酸盐气溶胶作为PM2.5的主要构成成分,是雾霾产生的一个重要元凶。科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制。如图所示:
(1)NO2和SO2作为大气初期污染物的主要成分,主要来自_____。
(2)电子传递可以促进HSO![]() 中O—H键的解离,进而形成中间体SO
中O—H键的解离,进而形成中间体SO![]() ,反应的离子方程式为_____。
,反应的离子方程式为_____。
(3)通过“水分子桥”,处于纳米液滴中的SO![]() 或HSO
或HSO![]() 可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____形成。写出HSO
可以将电子快速转移到周围的气相NO2分子。观察图示可知“水桥”主要靠____形成。写出HSO![]() 与NO2间发生的总反应的离子方程式:_____。
与NO2间发生的总反应的离子方程式:_____。
(4)亚硝酸(HNO2)是一种弱酸,酸性比醋酸稍强,极不稳定,只能存在于稀的水溶液中,加热时发生歧化反应,生成一种强酸和一种遇空气变为红棕色的气体,写出该反应的化学方程式:_____。
(5)结合题中信息,请写出一种鉴别NaNO2和NaCl的方法:_____。
【答案】自汽车尾气的排放,煤的燃烧,工业过程等 HSO3- + NO2 = SO3- + HNO2 氢键 HSO3- + 2NO2 + H2O = 2HNO2+ HSO4- 3HNO2![]() HNO3+2NO↑+H2O 用pH试纸分别测二种溶液的pH,pH>7的为NaNO2溶液,pH=7的为NaCl溶液
HNO3+2NO↑+H2O 用pH试纸分别测二种溶液的pH,pH>7的为NaNO2溶液,pH=7的为NaCl溶液
【解析】
(1) NO2和SO2主要来自汽车尾气的排放,煤的燃烧,工业过程等,故答案为:汽车尾气的排放,煤的燃烧,工业过程等;
(2)由图可知,HSO![]() 中O—H键的解离过程为:HSO
中O—H键的解离过程为:HSO![]() 和NO2反应得到SO
和NO2反应得到SO![]() 和HNO2,反应的离子方程式为:HSO3- + NO2 = SO3- + HNO2,故答案为:HSO3- + NO2 = SO3- + HNO2;
和HNO2,反应的离子方程式为:HSO3- + NO2 = SO3- + HNO2,故答案为:HSO3- + NO2 = SO3- + HNO2;
(3)由图可知,“水桥”主要靠“虚线”即氢键形成,由图可知,反应物有HSO![]() 、H2O、NO2,生成物有HSO4-和HNO2,即HSO
、H2O、NO2,生成物有HSO4-和HNO2,即HSO![]() 与NO2间发生的总反应化学方程式为:HSO3- + 2NO2 + H2O = 2HNO2+ HSO4-,故答案为:氢键;HSO3- + 2NO2 + H2O = 2HNO2+ HSO4-;
与NO2间发生的总反应化学方程式为:HSO3- + 2NO2 + H2O = 2HNO2+ HSO4-,故答案为:氢键;HSO3- + 2NO2 + H2O = 2HNO2+ HSO4-;
(4)红棕色的气体为NO2,HNO2中N元素化合价为+3价,则加热的产物之一为NO,NO种N元素化合价为+2价,加热发生歧化反应,则强酸应为HNO3,结合原子守恒可得HNO2加热发生的反应为:3HNO2![]() HNO3+2NO↑+H2O,故答案为:3HNO2
HNO3+2NO↑+H2O,故答案为:3HNO2![]() HNO3+2NO↑+H2O;
HNO3+2NO↑+H2O;
(5)HNO2是一种弱酸,则NaNO2溶液因NO2-的水解而显碱性,NaCl溶液显中性,所以可用pH试纸分别测二种溶液的pH,pH>7的为NaNO2溶液,pH=7的为NaCl溶液,故答案为:用pH试纸分别测二种溶液的pH,pH>7的为NaNO2溶液,pH=7的为NaCl溶液。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】1,2-二氯丙烷(CH2C1CHClCH3)是一种重要的化工原料,工业上可用丙烯加成法制备,主要副产物为3-氯丙烯(CH2=CHCH2C1),反应原理为:
I.CH2=CHCH3(g)+C12(g)![]() CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
CH2C1CHC1CH3(g) △H1=—134kJ·mol-1
II.CH2=CHCH3(g)+C12(g)![]() CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
CH2=CHCH2C1(g)+HC1(g)△H2=—102kJ·mol-1
请回答下列问题:
(1)已知CH2=CHCH2C1(g)+HC1(g)![]() CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
CH2C1CHC1CH3(g)的活化能Ea(正)为132kJ·mol-1,则该反应的活化能Ea(逆)为______kJ·mol-1。
(2)一定温度下,向恒容密闭容器中充入等物质的量的CH2=CHCH3(g)和C12(g)。在催化剂作用下发生反应I、Ⅱ,容器内气体的压强随时间的变化如下表所示。
时间/min | 0 | 60 | 120 | 180 | 240 | 300 | 360 |
压强/kPa | 80 | 74.2 | 69.4 | 65.2 | 61.6 | 57.6 | 57.6 |
①用单位时间内气体分压的变化来表示反应速率,即![]() ,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
,则前120min内平均反应速率v(CH2C1CHC1CH3)=______kPa·min-1。(保留小数点后2位)。
②该温度下,若平衡时HC1的体积分数为![]() ,则丙烯的平衡总转化率
,则丙烯的平衡总转化率![]() _______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
_______;反应I的平衡常数Kp=_____kPa-1(Kp为以分压表示的平衡常数,保留小数点后2位)。
(3)某研究小组向密闭容器中充入一定量的CH2=CHCH3和C12,分别在A、B两种不同催化剂作用下发生反应,一段时间后测得CH2C1CHC1CH3的产率与温度的关系如下图所示。
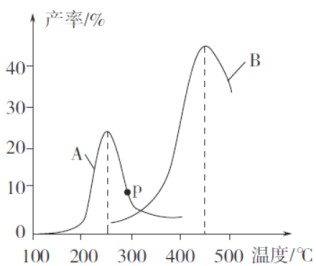
①下列说法错误的是___________(填代号)。
a.使用催化剂A的最佳温度约为250℃
b.相同条件下,改变压强不影响CH2C1CHC1CH3的产率
c.两种催化剂均能降低反应的活化能,但△H不变
d.提高CH2C1CHC1CH3反应选择性的关键因素是控制温度
②在催化剂A作用下,温度低于200℃时,CH2C1CHC1CH3的产率随温度升高变化不大,主要原因是_______________________________________________________________。
③p点是否为对应温度下CH2C1CHC1CH3的平衡产率,判断理由是_____________。