【题目】某实验小组用0.50mol·L-1 NaOH溶液和0.50mol·L-1硫酸溶液进行反应热的测定。
(1)写出该反应的热化学方程式[生成1 molH2O(l)时的反应热为-57.3 kJ·mol-1]:___。
(2)取50 mLNaOH溶液和30 mL 硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1.0g·mL-1,中和后生成溶液的比热容c=4.18J/(g·℃)。则生成1 mol H2O(l)时的反应热ΔH=___(取小数点后一位)。
③上述实验数值结果与-57.3kJ·mol-1有偏差,产生偏差的原因不可能是(填字母)___。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
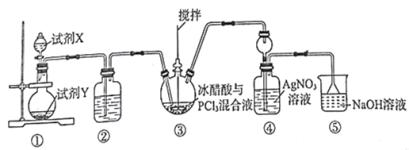
【题目】某兴趣小组制备一定量的乙酸乙酯.取3mL无水乙醇,2mL浓硫酸,2mL冰醋酸进行实验,用5mL饱和碳酸钠溶液收集产物。
I.实验装置如图所示
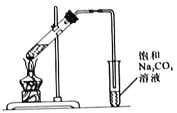
(1)制备乙酸乙酯的化学方程式为_______________。
(2)浓硫酸的作用是_______________。
(3)长导管的作用是_______________。
(4)接收装置还可选择下图中的___________。(填序号).
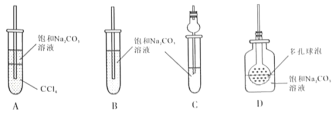
Ⅱ.甲同学用含有酚酞的饱和碳酸钠溶液(呈碱性)收集产物后振荡,发现红色迅速退去.
甲同学认为是蒸出的乙酸中和了碳酸钠.乙同学通过查阅资料并进行如下实验,证明甲同学的推测是错误的。
已知:酚酞难溶于水,易溶于有机溶剂;酚酞试剂是酚酞的乙醇溶液.
实验i,取振荡后的下层无色液体,分成两份,分别完成以下实验
序号 | 实验操作 | 实验现象 | 结论 |
1 | 滴加几滴酸酞试剂 | 溶液 ① (填“变红”成“不变红”) | 碳酸钠并未被乙酸完全中和,仍有大量剩余 |
2 | 滴入乙酸溶液 | 有大量气泡产生 |
实验ii.取振荡后的上层液体,加入 ② 溶液,振荡,发现出现浅红色,静置分层后红色消失。
实验iii,取5mL饱和碳酸钠溶液,滴入几滴酚酞试剂,再加入3mL乙酸乙酯(不含乙酸)振荡,溶液先变红,振荡后红色消失。回答下列问题
(5)完成上述实验:①_______________。②_______________。
(6)结合实验ii和实验iii的现象,可得出的结论是_______________。
(7)实验iii的实验目的是_______________。
【题目】把温度为20 ℃,浓度为1.0 mol/L的H2SO4溶液和2.2 mol/L的碱溶液各50 mL混合[溶液密度均为1g/mL,比热容为4.18 kJ/(kg·℃)]轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1 ℃ | 终止温度t2 ℃ |
H2SO4+NaOH | 20 | 33.6 |
H2SO4+NH3·H2O | 20 | 32.6 |
(1)反应NH3·H2O(aq)![]() NH4+ (aq)+OH-(aq)的焓变约____。
NH4+ (aq)+OH-(aq)的焓变约____。
(2)计算上述两组实验测出的中和热:ΔH1=___kJ/mol;ΔH2=__kJ/mol。
(3)由本题结论可预测将第1组中的1 mol/L的H2SO4溶液换成2mol/L的CH3COOH溶液进行实验,测得的中和热数值__(填“大于”“小于”或“等于”)56.848。