题目内容
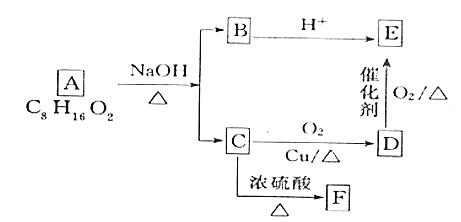
【题目】有人提出可以利用海水(含NaCl)和石灰石为原料制取漂白粉,该方法流程如下:
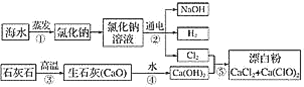
(1)②中的反应物是氯化钠和________,该反应的离子程式为_________。
(2)写出反应④、⑤的化学方程式:_________。
(3)图中反应②③④⑤属于氧化还原反应的是____________。
【答案】水 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ CaO+H2O=Ca(OH)2、2Cl2+ 2Ca(OH)2=CaCl2+ Ca(ClO)2+2H2O ②⑤
2OH-+H2↑+Cl2↑ CaO+H2O=Ca(OH)2、2Cl2+ 2Ca(OH)2=CaCl2+ Ca(ClO)2+2H2O ②⑤
【解析】
(1)②电解氯化钠和水生成氢氧化钠、氢气和氯气;
(2)反应④是氧化钙和水生成氢氧化钙、反应⑤是氯气和氢氧化钙生成氯化钙、次氯酸钙、水。
(3)反应前后有元素化合价改变的反应为氧化还原反应。
(1)②电解氯化钠溶液生成氢氧化钠、氢气和氯气,②中的反应物是氯化钠和水,反应的离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。
2OH-+H2↑+Cl2↑。
(2) 反应④是氧化钙和水生成氢氧化钙,反应的化学方程式是CaO+H2O=Ca(OH)2;反应⑤是氯气和氢氧化钙生成氯化钙、次氯酸钙、水,反应的化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O。
(3)②2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑、⑤2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O反应中有元素化合价的变化,属于氧化还原反应,③CaCO3
2OH-+H2↑+Cl2↑、⑤2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O反应中有元素化合价的变化,属于氧化还原反应,③CaCO3![]() CaO+CO2↑、④CaO+H2O=Ca(OH)2,反应中没有元素化合价的变化,不属于氧化还原反应。
CaO+CO2↑、④CaO+H2O=Ca(OH)2,反应中没有元素化合价的变化,不属于氧化还原反应。

 阅读快车系列答案
阅读快车系列答案【题目】已知2A(g)+B(g) ![]() 2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
2C(g),△H=-a kJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2molA和1molB,在500℃时充分反应达平衡后C的浓度为ωmol/L,放出热量为b kJ。
(1)比较a___b(填“>”“=”或“<”)。
(2)下表为不同温度下该反应的平衡常数。由此可推知,表中T1____T2(填“>” “=”或“<”)。
T/K | T1 | T2 | T3 |
K | 1.00×107 | 2.45×105 | 1.88×103 |
若在原来的容器中,只加入2molC,500℃时充分反应达平衡后,吸收热量为c kJ,C的浓度___(填“>”、“=”或“<”)ωmol/L,a、b、c之间满足何种关系_______(用代数式表示)。
(3)在相同条件下要想得到2a kJ热量,加入各物质的物质的量可能是_____。
A.4molA和2molB B.4molA、2molB和2molC C.4molA和4molB D.6molA和4molB
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是____。
A.及时分离出C气体 B.适当升高温度 C.增大B的浓度 D.选择高效催化剂
(5)若将上述容器改为恒压容器(反应前体积相同),起始时加入2molA和1molB,500℃时充分反应达平衡后,放出热量为d kJ,则d_____b(填“>”“=”或“<”),理由是_________。
(6)在一定温度下,向一个容积可变的容器中,加入3molA和2molB及固体催化剂,使之反应:2A(g)+B(g)![]() 2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
2C(g),平衡时容器内气体物质的量为起始时的90%。保持同一反应温度,在相同容器中,将起始物质的量改为4molA、3molB和2molC,则平衡时A的百分含量_____(填“不变”“变大”“变小”或“无法确定”)。
【题目】下列描述和解释均正确且有对应关系的是( )
选项 | 描述 | 解释 |
A | 84消毒液可以消灭新型冠状病毒 |
|
B | 用灼烧法鉴别纤维素和聚乙烯塑料 | 纤维素有烧焦羽毛的气味 |
C | 《易经》载有“泽中有火”上火下泽” | 燃烧的气体可能为水煤气 |
D | 《四川盐法志》记载;当煮盐近于饱和时,往卤水中点加豆汁,至渣滓皆浮聚于面 | 加豆汁除渣利用了胶粒的吸附作用 |
A.AB.BC.CD.D