题目内容
【题目】短周期主族元素![]() 的原子序数依次增大,W原子的最外层电子数等于Y原子最外层电子数的2倍;四种元素形成的一种化合物的结构如图所示,该化合物的阴离子中每个原子的最外层均满足8电子稳定结构,下列说法错误的是( )
的原子序数依次增大,W原子的最外层电子数等于Y原子最外层电子数的2倍;四种元素形成的一种化合物的结构如图所示,该化合物的阴离子中每个原子的最外层均满足8电子稳定结构,下列说法错误的是( )

A.原子半径:![]() B.W与Z形成晶体的基本单元为平面结构
B.W与Z形成晶体的基本单元为平面结构
C.X与Z在自然界中均不存在游离态D.W与Y形成的化合物可作耐火材料
【答案】B
【解析】
短周期主族元素W、X、Y、Z的原子序数依次增大,X、Y的简单离子为X+、Y3+,则X原子的最外层电子数是1、Y原子的最外层电子数是3,W原子的最外层电子数等于Y原子最外层电子数的2倍,则W为O、X为Na、Y为Al,由四种元素形成的一种化合物的结构图所示可知Z为+4价,且化合物中Z原子的最外层均满足8电子稳定结构,则Z为Si元素。
由分析知:W为O元素、X为Na元素、Y为Al元素、W为Si元素;
A.Na、Al、Si、S为同周期主族元素,核电荷数大,原子半径小,则原子半径Na>Al>Si>S,而O和S为同主族元素,S的原子半径大于O,则原子半径Na>Al>Si>O,故A正确;
B.O与Si组成的SiO2是原子晶体,是空间立体网状结构,故B错误;
C.Na是活泼金属,而Si是亲氧元素,则Na和Si在自然界均只有化合态,不存在游离态,故C正确;
D.Al2O3的熔点高,是高温耐火材料,故D正确;
故答案为B。

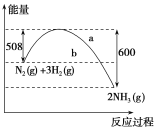
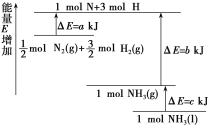
【题目】常温下,1mol化学键断裂形成气态原子所需要的能量用![]() 表示。结合表中信息判断下列说法不正确的是( )
表示。结合表中信息判断下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
A. 432kJ/mol>E(H-Br)>298kJ/mol B. 表中最稳定的共价键是H-F键
C. H2(g)→2H(g) △H=+436kJ/mol D. H2(g)+F2(g)=2HF(g) △H=-25kJ/mol
【题目】某实验小组用0.50mol·L-1 NaOH溶液和0.50mol·L-1硫酸溶液进行反应热的测定。
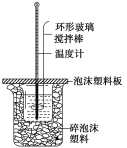
(1)写出该反应的热化学方程式[生成1 molH2O(l)时的反应热为-57.3 kJ·mol-1]:___。
(2)取50 mLNaOH溶液和30 mL 硫酸溶液进行实验,实验数据如表。
①请填写表中的空白:
温度 次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ___ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol·L-1NaOH溶液和0.50mol·L-1硫酸溶液的密度都是1.0g·mL-1,中和后生成溶液的比热容c=4.18J/(g·℃)。则生成1 mol H2O(l)时的反应热ΔH=___(取小数点后一位)。
③上述实验数值结果与-57.3kJ·mol-1有偏差,产生偏差的原因不可能是(填字母)___。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度