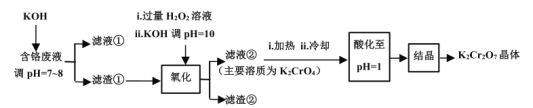
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO![]() 等)制备K2Cr2O7的流程如图所示。
等)制备K2Cr2O7的流程如图所示。
已知:I.在酸性条件下,H2O2能将Cr2O![]() 还原为Cr3+;
还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 2.8 |
请回答下列问题:
(1)滤渣①的主要成分__。
(2)加入H2O2的作用是(用离子方程式解释)__。
(3)加热的目的是__。
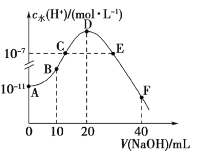
(4)“酸化”过程中发生反应的离子方程式为__;若该反应的平衡常数K=4×1014L3·mol-3,已知:“酸化”后溶液中c(Cr2O![]() )=1.6×10-3mol·L-1,则溶液中c(CrO
)=1.6×10-3mol·L-1,则溶液中c(CrO![]() )=__。
)=__。
(5)“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__。(计算结果保留四位有效数字)
+6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__。(计算结果保留四位有效数字)
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。
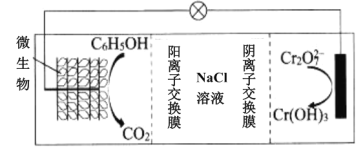
①负极的电极反应式为__;
②一段时间后,中间室中NaCl溶液的浓度__(填“增大”、“减小”或“不变”)。