题目内容
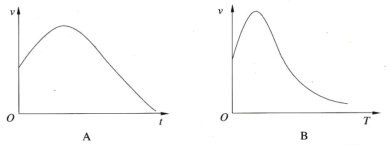
【题目】某密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g) ΔH<0。如图表示该反应的反应速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
2Z(g) ΔH<0。如图表示该反应的反应速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
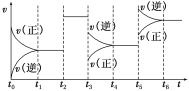
A.t2时加入了催化剂B.t3时降低了温度
C.t5时增大了压强D.t4~t5时间段内反应物转化率最小
【答案】A
【解析】
A.由图可知,t2时刻,改变了外界条件,正、逆反应速率同等程度增大,平衡不移动。由于该反应正反应是气体体积减小的反应,所以改变条件只能是使用催化剂,A正确;
B.t3时刻,改变外界条件,使正、逆反应速率都降低,且正反应速率降低更多,平衡向逆反应移动。由于该反应正反应是放热反应,温度降低,平衡向正反应移动,故改变的外界条件不可能为降低温度,B错误;
C.t5时刻,改变外界条件,使正、逆反应速率都增大,且逆反应速率增大更多,平衡向逆反应移动。由于该反应正反应是气体体积减小的反应,增大压强平衡向正反应移动,与图象不符合,C错误;
D.由上述分析可知,t2时刻,使用催化剂,平衡不移动,X的转化率不变,t3时刻,减小压强,平衡向逆反应移动,X的转化率降低,t5时刻,升高温度,平衡向逆反应移动,X的转化率继续降低,故在t6时刻,X的转化率最低,D错误;
故合理选项是A。

 名校课堂系列答案
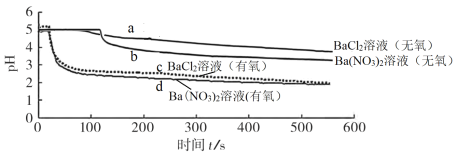
名校课堂系列答案【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2