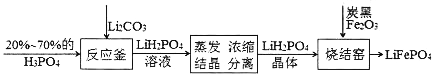
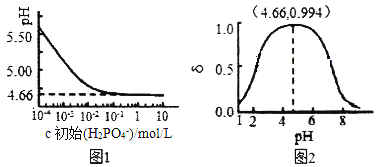
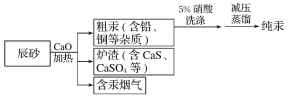
题目内容
【题目】有一处于平衡状态的反应X(g) +3Y(g)![]() 2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
2Z(g) (正反应是放热反应) 。为了使平衡向生成Z的方向移动, 应选择的条件是
①升高温度 ②降低温度 ③增大压强 ④降低压强 ⑤加入正催化剂 ⑥分离出Z
A. ①③⑤ B. ②③⑤ C. ②③⑥ D. ②④⑥
【答案】C
【解析】
根据影响化学平衡移动的因素:升高温度、平衡向着吸热方向移动,降低温度,平衡向着放热方向移动;升高压强,平衡向着气体体积减小的方向移动,降低压强,平衡向气体体积增大的方向移动;增大反应物浓度或者减小生成物浓度平衡都向正方向移动;催化剂只改变反应速率不改变平衡移动。
反应X(g) +3Y(g)![]() 2Z(g)是一个放热反应,,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故①错误,②正确;增大压强,平衡向着气体体积减小的方向即逆向进行,减小压强,平衡正向移动,故③正确,④错误;加催化剂不会引起化学平衡的移动,故⑤错误;分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确;综上所述,②③⑥符合题意,本题选C。
2Z(g)是一个放热反应,,所以升高温度,平衡逆向移动,降低温度,平衡正向移动,故①错误,②正确;增大压强,平衡向着气体体积减小的方向即逆向进行,减小压强,平衡正向移动,故③正确,④错误;加催化剂不会引起化学平衡的移动,故⑤错误;分离出Z,即减小生成物的浓度,平衡正向移动,故⑥正确;综上所述,②③⑥符合题意,本题选C。

练习册系列答案
相关题目