题目内容
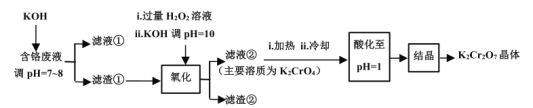
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO![]() 等)制备K2Cr2O7的流程如图所示。
等)制备K2Cr2O7的流程如图所示。
已知:I.在酸性条件下,H2O2能将Cr2O![]() 还原为Cr3+;
还原为Cr3+;
Ⅱ.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Cr3+ | 4.9 | 6.8 |
Fe3+ | 1.5 | 2.8 |
请回答下列问题:
(1)滤渣①的主要成分__。
(2)加入H2O2的作用是(用离子方程式解释)__。
(3)加热的目的是__。
(4)“酸化”过程中发生反应的离子方程式为__;若该反应的平衡常数K=4×1014L3·mol-3,已知:“酸化”后溶液中c(Cr2O![]() )=1.6×10-3mol·L-1,则溶液中c(CrO
)=1.6×10-3mol·L-1,则溶液中c(CrO![]() )=__。
)=__。
(5)“结晶”后得到K2Cr2O7(M=294g·mol-1)产品0.6000g,将其溶解后用稀H2SO4酸化,再用浓度为0.01000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定,滴定反应为:Cr2O![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__。(计算结果保留四位有效数字)
+6Fe2++14H+=2Cr3++6Fe3++7H2O,滴定终点消耗标准溶液的体积为900mL,则产品的纯度为__。(计算结果保留四位有效数字)
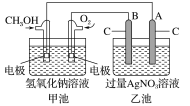
(6)在K2Cr2O7存在下,可利用微生物电化学技术实现含苯酚(C6H5OH)废水的有效处理,其工作原理如图所示。
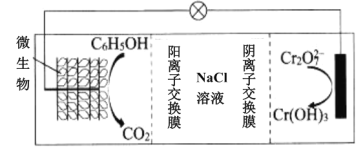
①负极的电极反应式为__;
②一段时间后,中间室中NaCl溶液的浓度__(填“增大”、“减小”或“不变”)。
【答案】Fe(OH)3和Cr(OH)3 2Cr(OH)3+3H2O2+4OH-=2CrO![]() +8H2O 除去过量H2O2,防止将Cr2O
+8H2O 除去过量H2O2,防止将Cr2O![]() 还原成Cr3+ 2CrO
还原成Cr3+ 2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O 2×10-8mol/L 73.50% C6H5OH+11H2O-28e-=6CO2↑+28H+ 减小
+H2O 2×10-8mol/L 73.50% C6H5OH+11H2O-28e-=6CO2↑+28H+ 减小
【解析】
含铬废液(主要含Cr3+、Fe3+、K+、SO![]() 等)制备K2Cr2O7的流程:废液与足量KOH反应生成沉淀Cr(OH)3、Fe(OH)3,过滤得到滤渣①Cr(OH)3、Fe(OH)3混合物,除去K+、SO
等)制备K2Cr2O7的流程:废液与足量KOH反应生成沉淀Cr(OH)3、Fe(OH)3,过滤得到滤渣①Cr(OH)3、Fe(OH)3混合物,除去K+、SO![]() 等离子,碱性条件下在滤渣中加入过氧化氢氧化Cr(OH)3生成K2CrO4,过滤除去Fe(OH)3,得到K2CrO4滤液②,加热除去过量过氧化氢,防止后续加酸时H2O2能将Cr2O
等离子,碱性条件下在滤渣中加入过氧化氢氧化Cr(OH)3生成K2CrO4,过滤除去Fe(OH)3,得到K2CrO4滤液②,加热除去过量过氧化氢,防止后续加酸时H2O2能将Cr2O![]() 还原为Cr3+,加酸调pH=1,使K2CrO4溶液转化为K2Cr2O7溶液,蒸发结晶得到K2Cr2O7晶体,以此解答该题。
还原为Cr3+,加酸调pH=1,使K2CrO4溶液转化为K2Cr2O7溶液,蒸发结晶得到K2Cr2O7晶体,以此解答该题。
(1)由以上分析可知滤渣①的主要成分是Fe(OH)3和Cr(OH)3;
(2)“氧化”步骤中,碱性条件下,过氧化氢氧化Cr(OH)3生成K2CrO4溶液,反应的离子方程式为2Cr(OH)3+3H2O2+4OH-=2CrO![]() +8H2O;
+8H2O;
(3)因为在酸性条件下,H2O2能将Cr2O![]() 还原为Cr3+,为防止后续“酸化”步骤中H2O2将Cr2O
还原为Cr3+,为防止后续“酸化”步骤中H2O2将Cr2O![]() 还原为Cr3+而混入杂质,所以酸化之前必须除去H2O2,并且H2O2对热不稳定、易分解,通过加热可除去;
还原为Cr3+而混入杂质,所以酸化之前必须除去H2O2,并且H2O2对热不稳定、易分解,通过加热可除去;
(4)“酸化”过程中发生反应的离子方程式为2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O;酸化”过程中pH=1,即c(H+)=0.1mol/L,反应2CrO
+H2O;酸化”过程中pH=1,即c(H+)=0.1mol/L,反应2CrO![]() +2H+
+2H+![]() Cr2O
Cr2O![]() +H2O的平衡常数K=
+H2O的平衡常数K=![]() =
=![]() =4×1014,解得
=4×1014,解得![]() =2×10-8molL-1;
=2×10-8molL-1;
(5)由反应Cr2O![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O有n(K2Cr2O7)=
+6Fe2++14H+=2Cr3++6Fe3++7H2O有n(K2Cr2O7)=![]() n[(NH4)2Fe(SO4)2]=
n[(NH4)2Fe(SO4)2]=![]() ×0.0100mol/L×0.9L=0.0015mol,产品的纯度=0.0015mol×294g/mol/0.6000g×100%=73.50%;
×0.0100mol/L×0.9L=0.0015mol,产品的纯度=0.0015mol×294g/mol/0.6000g×100%=73.50%;
(6)①C6H5OH→CO2,则苯酚发生氧化反应、作负极,结合电子守恒和电荷守恒有电极反应式C6H5OH+11H2O-28e-=6CO2↑+28H+;
②由于电解质NaCl溶液被阳离子交换膜和阴离子交换膜隔离,使Na+和Cl-不能定向移动,所以电池工作时,负极生成的H+透过阳离子交换膜加入NaCl溶液中,正极生成的OH-透过阴离子交换膜进入NaCl溶液中与H+反应生成水,是NaCl溶液浓度减小。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060