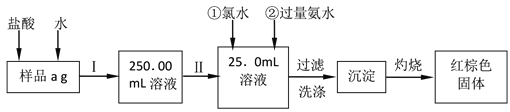
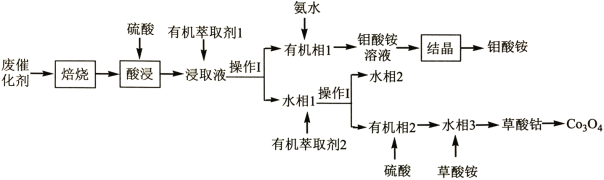
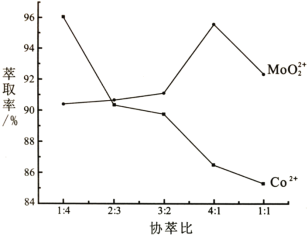
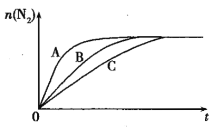
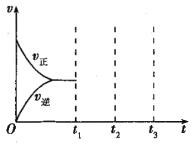
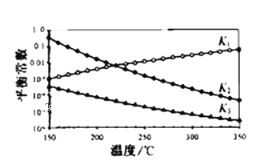
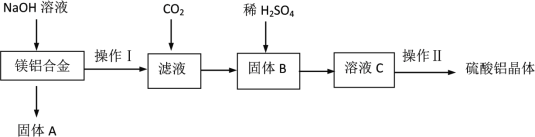
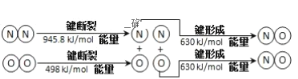
0 198432 198440 198446 198450 198456 198458 198462 198468 198470 198476 198482 198486 198488 198492 198498 198500 198506 198510 198512 198516 198518 198522 198524 198526 198527 198528 198530 198531 198532 198534 198536 198540 198542 198546 198548 198552 198558 198560 198566 198570 198572 198576 198582 198588 198590 198596 198600 198602 198608 198612 198618 198626 203614