题目内容
【题目】对CO2及氮氧化物的研究有更大意义:
(1)CO2与H2可用来合成可再生能源甲醇,已知CH3OH(l)标准燃烧热△H=-726.5kJ/mol、H2的燃烧热数值为285.8kJ/mol,则CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=___。
CH3OH(l)+H2O(l) △H=___。
(2)用NH3催化还原NOx时包含以下反应。
反应I:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H1<0
5N2(g)+6H2O(l) △H1<0
反应Ⅱ:4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g) + 6H2O(l) △H2>0
5N2(g)+3O2(g) + 6H2O(l) △H2>0
反应Ⅲ:2NO(g) +O2(g)![]() 2NO2(g) △H3<0
2NO2(g) △H3<0
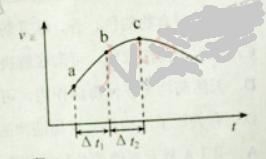
① 反应I在容积固定密闭容器内进行,选用不同的催化剂,反应产生N2的量随时间变化如图所示。下列说法正确的是___。
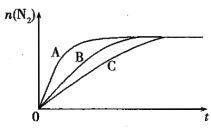
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
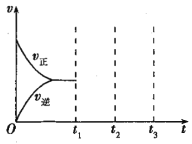
②将物质的量之比为2:1的NO、O2混合气体置于恒温密闭容器中发生反应Ⅲ,正、逆反应速率随时间变化曲线如图所示。在t1时,保持容器压强不变,充入一定量的NO2,t2时建立新的平衡,请在答题纸中画出t1~t3正、逆反应速率随时间变化曲线。___
(3)一定条件下,由CO2和H2制备甲醇的过程中含有下列反应:
反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3
其对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图所示。则△H2__△H3(填“大于”、“小于”、“等于”),理由是___。
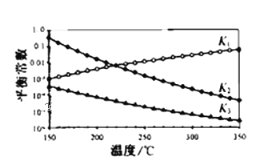
【答案】-130.9kJ/mol CD 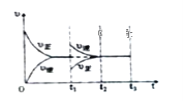 小于 由图l可知,随着温度升高,K1增大,则△H1>0,根据盖斯定律又得△H3=△H1+△H2,所以△H2<△H3
小于 由图l可知,随着温度升高,K1增大,则△H1>0,根据盖斯定律又得△H3=△H1+△H2,所以△H2<△H3
【解析】
(1)题给的两个燃烧热化学方程式为
CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/mol ①
H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol ②
则3×②-①得:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130.9kJ/mol
CH3OH(l)+H2O(l) △H=-130.9kJ/mol
答案为:CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l) △H=-130.9kJ/mol
CH3OH(l)+H2O(l) △H=-130.9kJ/mol
(2) ①对于反应4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l) △H1<0
5N2(g)+6H2O(l) △H1<0
A.从图中可以看出,达平衡前n(N2)的关系为A>B>C,即表明反应速率A>B>C,该反应的活化能大小顺序是:Ea(A)<Ea(B)<Ea(C),A错误;
B.增大压强能使反应速率加快,是因为增加了活化分子数,但活化分子百分数不变,B错误;
C.从反应式可以看出,4NH3、6H2O所含H-O键与N-H键的数目相等,所以当单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡,正确;
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡,正确。
故答案为CD
②在t1时,保持容器压强不变,充入一定量的NO2。则在充入NO2的瞬间,c(NO2)增大,c(NO)、c(O2)减小,即正反应速率增大,同时逆反应速率减小,在t2时建立新的平衡,t2~t3段速率不变。
答案为:
(3) 反应1:CO2(g)+H2(g)CO(g)+H2O(g) △H1
反应2:CO(g)+2H2(g)CH3OH(g) △H2
将反应1+反应2,可得反应3:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3=△H1+△H2
由图象信息知,随着温度的升高,K1增大,K2、K3减小,说明反应1为吸热反应,反应2、反应3为放热反应,即△H1>0、△H2<0、△H3<0
再由△H3=△H1+△H2,便可得出:△H2<△H3
答案为:由图l可知,随着温度升高,K1增大,则△H1>0,根据盖斯定律又得△H3=△H1+△H2,所以△H2<△H3

【题目】某小组同学通过实验研究FeCl3溶液与Cu发生的氧化还原反应,实验记录如下表所示,下列说法错误的是( )
序号 | Ⅰ | Ⅱ | Ⅲ |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜有剩余,溶液黄色褪去,变成蓝色加入蒸馏水后无白色沉淀 |
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液中阴离子种类有关
C.实验Ⅱ、Ⅲ中加水后c(Cu2+)相同
D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀