��Ŀ����
����Ŀ�������仯�����ڹ�ũҵ����������������Ҫ���á��밴Ҫ��ش�����������⣺
��1����������������ʱҲ������N2��O2��Ӧ����������Ⱦ��NO���������仯ʾ��ͼΪ
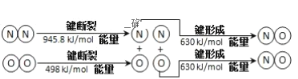
��÷�Ӧ���Ȼ�ѧ����ʽΪ___��
��2����ҵ�ϳɰ��ķ�Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H<0���ֱ���T1��T2�¶��£��ı���ʼ�������ʵ��������ƽ��ʱ�������������ͼ��ʾ��
2NH3(g) ��H<0���ֱ���T1��T2�¶��£��ı���ʼ�������ʵ��������ƽ��ʱ�������������ͼ��ʾ��
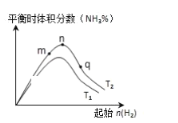
�ٱȽ���m��n��q����������ƽ��״̬�У���Ӧ��N2��ת������ߵ���___�㡣
��T2�����£���2L���ܱ������У�����xmolN2��ymolH2ʱ��3min��ƽ�⣬��ʱ��Ӧ���ת���ʾ�Ϊa��д�����н���a��x�ı���ʽ�����ػ���v(N2)=___���÷�Ӧ��ƽ�ⳣ����ֵK=___��
��ͼ����T2___T1��������������������������������������ȷ��������
���𰸡�N2(g)+O2(g)=2NO(g) ��H=+183.8kJ/mol q ax/6mol��L��1��min��1 16(ax)2/[(x-ax) (3x-3ax)3] ����
��������
(1) ��H=E(N2)+E(O2)-2E(NO)=945.8kJ/mol+498kJ/mol-2��630kJ/mol=183.8kJ/mol
��÷�Ӧ���Ȼ�ѧ����ʽΪN2(g)+O2(g)=2NO(g) ��H=+183.8kJ/mol
��ΪN2(g)+O2(g)=2NO(g) ��H=+183.8kJ/mol
(2) �� ����N2(g)+3H2(g)![]() 2NH3(g)����������H2�����ʵ�����ƽ�ⲻ�������ƶ�����Ӧ��N2��ת���ʲ�������������m��n��q����������ƽ��״̬�У���Ӧ��N2ת������ߵĵ���q�㡣��Ϊq
2NH3(g)����������H2�����ʵ�����ƽ�ⲻ�������ƶ�����Ӧ��N2��ת���ʲ�������������m��n��q����������ƽ��״̬�У���Ӧ��N2ת������ߵĵ���q�㡣��Ϊq
�ڷ�Ӧ���ת���ʾ�Ϊa����������Ӧ������ʵ���֮�ȵ��ڻ�ѧ������֮�ȣ���y=3x
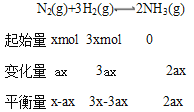
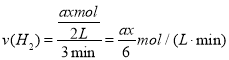 ��Ϊax/6mol��L��1��min��1
��Ϊax/6mol��L��1��min��1
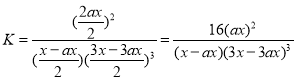 ��Ϊ16(ax)2/[(x-ax) (3x-3ax)3]
��Ϊ16(ax)2/[(x-ax) (3x-3ax)3]
��Ϊ����ӦΪ���ȷ�Ӧ��T2ʱ�������������˵���¶���T1�ı䵽T2ʱ��ƽ�������ƶ�������ͼ����T2<T1����Ϊ <��

����Ŀ������̼�Ļ�������������������������Ź㷺��Ӧ�á���ش��������⣺
��1���������ǹ�ҵ��ұ������ԭ��֮һ��
��֪����Fe3O4��s��+4C��s��![]() 3Fe��s��+4CO��g�� ��H=+646.0kJmol��1
3Fe��s��+4CO��g�� ��H=+646.0kJmol��1
��C��s��+CO2��g��2CO��g�� ��H=+172.5kJmol��1
��Fe3O4��s��+4CO��g��![]() 3Fe��s��+4CO2��g����H=___��
3Fe��s��+4CO2��g����H=___��
��2����ӦFe��s��+CO2��g��![]() FeO��s��+CO��g����H��ƽ�ⳣ��ΪK���ڲ�ͬ�¶��£�Kֵ���£�
FeO��s��+CO��g����H��ƽ�ⳣ��ΪK���ڲ�ͬ�¶��£�Kֵ���£�
�¶�/K | 973 | 1173 | 1373 | 1573 |
K | 1.47 | 2.15 | 3.36 | 8.92 |
�ٴӱ������ݿ��ƶϣ��÷�Ӧ��___��������������������������Ӧ��
���¶�Ϊ973Kʱ����ij�����ܱ������з���������Ӧ�������й�˵����˵���÷�Ӧ�Ѵﵽƽ��״̬����___������ĸ����
A��c��CO2��=c��CO��
B��v����CO2��=v����CO��
C����ϵѹǿ����
D�����������c��CO������
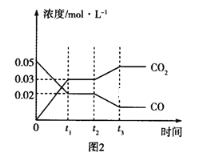
��3����ͼͼ1��2��ʾ��Ӧ��H2��g��+CO2��g��![]() CO��g��+H2O��g����H��0�й����뷴Ӧʱ��֮��Ĺ�ϵ��
CO��g��+H2O��g����H��0�й����뷴Ӧʱ��֮��Ĺ�ϵ��
��ͼ2����t1=0.5min����0��t1ʱ����ڣ�H2O��ƽ����Ӧ����v��H2O��=___molL��1s��1��
��ͼ1��t2ʱ�̸ı��������___����д���֣���ͬ����ͼ2��t2ʱ�̸ı��������___��