题目内容
【题目】将3molA和1molB混合于一体积可变的密闭容器P中,以此时的温度、压强和体积作为起始条件,发生如下反应:3A(g)+B(g)![]() 2C(g)+D(g),达到平衡时C的浓度为wmol/L。回答下列问题:
2C(g)+D(g),达到平衡时C的浓度为wmol/L。回答下列问题:
(1)保持温度和压强不变,按下列四种配比充入容器P中有关物质,平衡后C的浓度仍为wmol/L的是___。
A.6molA+2 molB B.3molA+1molB+2molC
C.2molC+1molB+1molD D.1molC+2molD
(2)保持原起始温度和体积不变,要使平衡后C的浓度仍为wmol/L,应按下列哪种配比向容器Q中充入有关物质___。
A.3molA+1 molB
B.4molC+2molD
C.1.5molA+0.5molB+1molC+0.5molD
D.无法判断
(3)保持原起始温度和体积不变,若仍按3molA和1molB配比在容器Q中发生反应,则平衡时C的浓度和wmol/L的关系是___。
A.大于wmol/L B.小于wmol/L C.等于wmol/L D.无法比较
(4)将2molC和2molD按起始温度和压强充入容器Q中,保持温度和体积不变,平衡时C的浓度为vmol/L,则v和w的关系是___。
A.v>w B.v<w C.v=w D.无法比较
(5)将题干中的体积可变的密闭容器P改为恒容条件,在某温度下,将2.4molA和0.8molB混合于该容器中发生上述反应,达到平衡时C的物质的量为nmol。若A、B、C、D起始的物质的量分别用a、b、c、d表示,保持恒温恒容,要使反应开始时向逆反应进行,且达到平衡后C的物质的量仍为n mol,则起始时C的物质的量取值范围是___。
【答案】A D B B (n,1.6]
【解析】
(1)为了便于利用题干信息,我们可以认为此时的温度、压强都与题干中反应达平衡时的温度、压强相等。平衡后C的浓度仍为wmol/L,则起始投入量也应与题干中对应成比例。
A.6molA+2 molB,A、B的物质的量之比为3:1,符合题干中A、B的物质的量之比为3:1;
B.3molA+1molB+2molC,不符合题干中A、B的物质的量之比为3:1;
C.2molC+1molB+1molD,不能转化成题干中A、B的物质的量之比为3:1;
D.1molC+2molD,不能转化成题干中A、B的物质的量之比为3:1。
故选A。
(2)保持原起始温度和体积不变,则要使平衡后C的浓度仍为wmol/L,投入量仍需满足A、B的物质的量之比为3:1的关系,但投入量与体积之比应与题干中起始投入量与平衡时的体积之比相同。
A.3molA+1 molB,不一定满足投入量与体积之比与题干中起始投入量与平衡时的体积之比相同.
B.4molC+2molD,不一定满足投入量与体积之比与题干中起始投入量与平衡时的体积之比相同
C.1.5molA+0.5molB+1molC+0.5molD,不一定满足投入量与体积之比与题干中起始投入量与平衡时的体积之比相同;
D.无法判断,则是此题的唯一选择。
故答案为D。
(3)保持原起始温度和体积不变,若仍按3molA和1molB配比在容器Q中发生反应,则相当于题干中平衡混合气减压,平衡时C的浓度减小。故选B。
(4)将2molC和2molD按起始温度和压强充入容器Q中,保持温度和体积不变。我们可认为先加入2molC和1molD,平衡时C的浓度为wmol/L;再充入1molD,平衡逆向移动,C的浓度减小,若再考虑充入C后容器体积要增大,则C的浓度将更小。故答案为B。
(5) 3A(g)+B(g)![]() 2C(g)+D(g)
2C(g)+D(g)
起始量 2.4 0.8 0 0
变化量 3/2n 1/2n n 1/2n
平衡量 2.4-3n/2 0.8-n/2 n 1/2n
起始量 a b c d
我们利用极值法求解。当起始投入量正好为平衡量时,c=n;当起始时反应物为0时,c=1.6mol。
因为要求平衡逆向移动,所以c=n这一点不符合题意,应舍去。
故答案为:(n,1.6]

 小学生10分钟口算测试100分系列答案
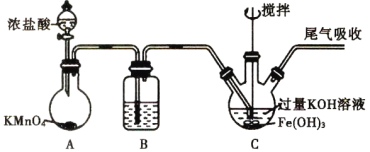
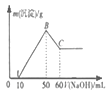
小学生10分钟口算测试100分系列答案【题目】下列实验与图象对应的是
选项 | A | B | C | D |
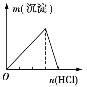
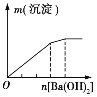
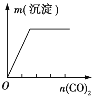
实验 | NaAlO2溶液中逐滴滴加盐酸至过量 | AlCl3溶液中逐滴滴加氨水至过量 | 明矾溶液中逐滴滴加Ba(OH)2溶液至过量 | 澄清石灰水中缓慢通入CO2至过量 |
图象 |
|
|
|
|
A. AB. BC. CD. D
【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
则下列说法中不正确的是( )
A. 碳酸的酸性强于氢硫酸
B. 多元弱酸的酸性主要由第一步电离决定
C. 常温下,加水稀释醋酸,![]() 增大
增大
D. 向弱酸溶液中加少量NaOH溶液,电离常数不变