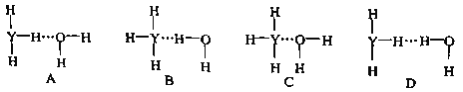
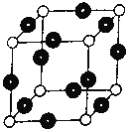
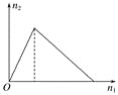
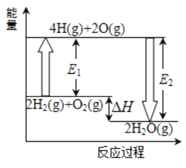
0 198093 198101 198107 198111 198117 198119 198123 198129 198131 198137 198143 198147 198149 198153 198159 198161 198167 198171 198173 198177 198179 198183 198185 198187 198188 198189 198191 198192 198193 198195 198197 198201 198203 198207 198209 198213 198219 198221 198227 198231 198233 198237 198243 198249 198251 198257 198261 198263 198269 198273 198279 198287 203614