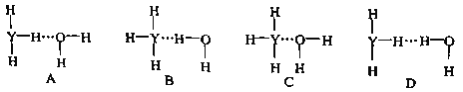
题目内容
【题目】恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图所示。已知:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
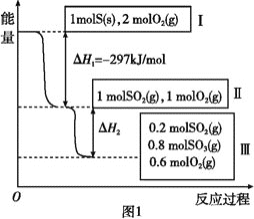
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式:________________。
(2)状态Ⅱ到状态Ⅲ放出的热量为__________。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣_____(填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为______,若溶液中发生了氧化还原反应,则该过程的离子方程式为:_______________。
【答案】S(s)+O2(g)=SO2(g) ΔH=-297 kJ/mol 78.64 kJ 大 2 mol 2SO2+O2+4OH-=2SO42-+2H2O
【解析】
由图可知,状态Ⅰ到状态Ⅱ为硫燃烧生成二氧化硫的过程,反应的热化学方程式为. S(s)+O2(g)=SO2(g) ΔH=-297 kJ/mol;状态Ⅱ到状态Ⅲ二氧化硫发生催化氧化反应生成三氧化硫,反应的热化学方程式为2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
(1)燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物放出的热量,由图可知1molS(s)完全燃烧放出的热量为297KJ,则能表示硫的燃烧热的热化学方程式为S(s)+O2(g)=SO2(g) ΔH=-297 kJ/mol,故答案为:S(s)+O2(g)=SO2(g) ΔH=-297 kJ/mol;
(2)由图可知,状态Ⅱ到状态Ⅲ时0.8mol二氧化硫参与反应,则反应放出的热量为![]() =8.64 kJ,故答案为:8.64 kJ;
=8.64 kJ,故答案为:8.64 kJ;
(3)恒温恒容时,开始为1molSO2和2molO2与开始为1molSO2和1molO2相比,氧气的浓度增大,增大反应物浓度,平衡向正反应方向移动,SO2转化率增大,反应放出热量的数值比Q2大,故答案为:大;
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中,三氧化硫与氢氧化钠反应反应生成硫酸钠,混合气体中的二氧化硫和氧气在氢氧化钠溶液中发生氧化还原反应生成硫酸钠和水,反应的离子方程式为2SO2+O2+4OH-═2SO42-+2H2O,因反应最后得到硫酸钠溶液,根据钠原子和硫原子原子守恒可得n(NaOH)=2n(S)=2×(0.2+0.8)mol=2mol,故答案为:2;2SO2+O2+4OH-═2SO42-+2H2O;

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案