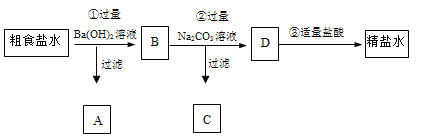
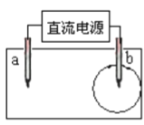
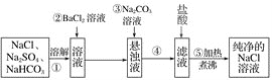
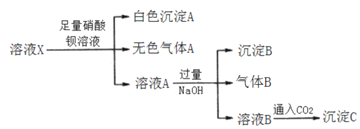
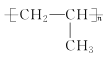题目内容
【题目】已知拆开1mol氢气中的化学键需要消耗436kJ能量,拆开1mol氧气中的化学键需要消耗498kJ能量,2mol氢气完全燃烧生成气态水放出482kJ热量,根据下面的能量图,回答下列问题:
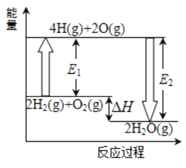
(1)分别写出E1 、E2的数值:E1=_______________;E2=_______________。
(2)生成H2O(g)中的1molH-O键放出_______kJ的能量。
(3)已知:H2O(l)=H2O(g) △H=+44kJmol-1,试写出2mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式:______________。
【答案】1370 1852 463 2H2(g)+O2(g)=2H2O(l) △H=-570kJ·mol-1
【解析】
化学反应的实质是旧键的断裂和新键的生产,化学键断裂要吸收能量,形成新键要放出能量,由题意和图象可知反应的热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-482kJmol-1,反应的焓变△H=反应物键能之和-生成物键能之和,E1为反应物键能之和,E2为生成物键能之和。
(1)E1为拆开2molH2和1molO2中的化学键需要吸收的能量,则E1=2×436kJ/mol+498 kJ/mol =1370 kJ/mol,由题意和图象可知2mol氢气完全燃烧生成气态水的热化学方程式为2H2(g)+O2(g)=2H2O(g)△H=-482 kJ/mol,反应的焓变△H=反应物键能之和-生成物键能之和,则E2=E1—△H=1370 kJ/mol—(-482 kJ/mol)=1852 kJ/mol,故答案为:1370;1852;
(2)由E2为1852 kJ/mol可知生成2molH2O放出1852kJ能量,则生成H2O(g)中的1molH-O键放出![]() =463 kJ,故答案为:463;
=463 kJ,故答案为:463;
(3)已知①2H2(g)+O2(g)=2H2O(g)△H=-482kJmol-1,②H2O(l)=H2O(g)△H=+44kJmol-1,由盖斯定律可知,①-②×2可得2H2(g)+O2(g)=2H2O(l),则△H=-570kJ/mol,2mol氢气在足量氧气中完全燃烧生成液态水的热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=-570kJ/mol,故答案为:2H2(g)+O2(g)=2H2O(l)△H=-570kJ/mol。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案