题目内容
【题目】如图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
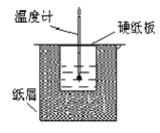
(1)从实验装置上看,图中伤缺少的一种玻璃仪器是_____________;
(2)烧杯间填满碎纸条的作用是____________________;
(3)若大烧杯上不盖硬纸板,求得的反应热数值__________(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60 mL 0.50 mol·L-1HCl跟50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”),所求中和热__________(填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会________(填“偏大”“偏小”或“无影响”)。
(6)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热数值____________(填“偏大”、“偏小”或“不变”)。
(7)量取溶液时,仰视读数。测得的中和热数值________(填“偏大”、“偏小”或“无影响”)
(8)实验过程中有液体洒在外面,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
(9)混合酸、碱溶液时,动作缓慢,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
(10)实验中能否用环形铁(铜)丝搅拌棒代替环形玻璃搅拌棒,测得的中和热数值会______(填 “偏大”、“偏小”或“无影响”)
【答案】环形玻璃搅拌棒 减少实验过程中的热量损失 偏小 不相等 相等 偏小 偏大 偏小 偏小 偏小 偏小
【解析】
(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒能使溶液上下混合均匀,保证溶液上下的温度达到一致,减少实验误差;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失;
(3)若大烧杯上不盖硬纸板,会导致热量损失;
(4)改变酸或碱的用量,可以改变反应中放出的热量,但不能改变中和热;
(5)一水合氨为弱碱,氨水的电离是一个吸热过程;
(6)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小;
(7)量取溶液的体积时仰视读数,会导致所量的氢氧化钠溶液和盐酸溶液体积偏大;
(8)实验过程中有液体洒在外面,会导致参与反应的反应物的物质的量减小;
(9)混合酸、碱溶液时,动作缓慢,会导致热量损失;
(10)环形铁(铜)丝导热,会导致热量损失。
(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒能使溶液上下混合均匀,保证溶液上下的温度达到一致,减少实验误差,所以还缺少环形玻璃搅拌棒,故答案为:环形玻璃搅拌棒;
(2)中和热测定实验成败的关键是保温工作,大小烧杯之间填满碎纸条的作用是减少实验过程中的热量损失,故答案为:减少实验过程中的热量损失;
(3)若大烧杯上不盖硬纸板,会导致热量损失,使求得的反应热数值偏小,故答案为:偏小;
(4)中和热是在一定条件下,稀溶液中酸和碱反应生成1mol水时放出的热量,改变酸或碱的用量,可以改变反应中放出的热量,但不能改变中和热,故答案为:不变;
(5)一水合氨为弱碱,氨水的电离是一个吸热过程,吸热导致测得的中和热数值会偏小,故答案为:偏小;
(6)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小,放出的热量偏小,测得的中和热数值偏小,故答案为:偏小;
(7)量取溶液的体积时仰视读数,会导致所量的氢氧化钠溶液和盐酸溶液体积偏大,参与反应的反应物偏多,放出的热量偏大,故答案为:偏大;
(8)实验过程中有液体洒在外面,会导致参与反应的反应物的物质的量减小,使测得的中和热数值会偏小,故答案为:偏小;
(9)混合酸、碱溶液时,动作缓慢,会导致热量损失,使测得的中和热数值会偏小,故答案为:偏小;
(10)实验中能否用环形铁(铜)丝搅拌棒代替环形玻璃搅拌棒,环形铁(铜)丝导热,会导致热量损失,使测得的中和热数值会偏小,故答案为:偏小。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案