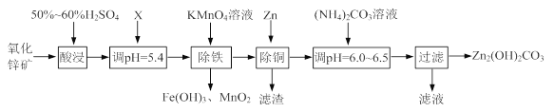
【题目】(1)葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使 所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
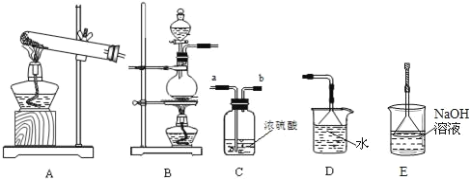
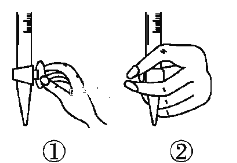
①滴定前排气泡时,应选择下图中的________(填序号)。
②若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
①=10 mL ②=40 mL ③<10 mL ④>40 mL。
③上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:_____。
④滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)___________________________
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。
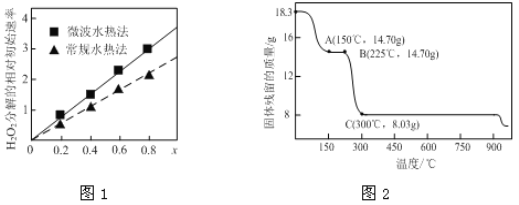
【题目】(1)已知常温时,0.1 mol/L醋酸在水中有0.1%发生电离,则该溶液的pH=__,醋酸的电离平衡常数K=__。
(2)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如下图所示:
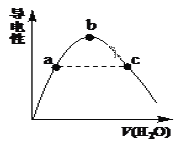
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是_____________。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a 点溶液中的c(CH3COO-) __c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
(3)已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8 | Ka1=4.3 | Ka=3.0 |
①物质的量浓度均为0.1mol/L的四种溶液:pH由小到大排列的顺序是______(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
②写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________。