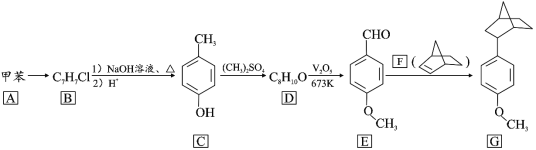
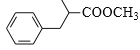
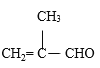题目内容
【题目】回答下列问题
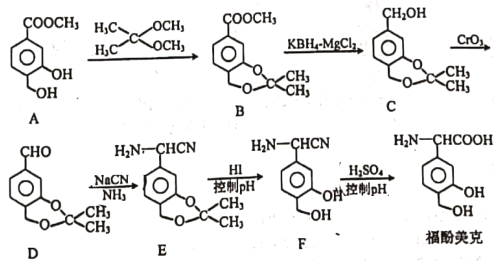
(1)请写出一定条件下 Cu 与浓硫酸反应制取二氧化硫的化学方程式:___________。该反应中发生氧化反应的物质是__________,1mol氧化剂得到__________mol电子。
(2)PH< ______的雨称为酸雨。向煤中加入适量的______可大大减少燃烧产物中二氧化硫的含量。
(3)一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比为__________。
【答案】Cu+2H2SO4(浓)![]() CuSO4 +SO2↑+2H2O Cu 2mol 5.6 石灰石或生石灰 2:3
CuSO4 +SO2↑+2H2O Cu 2mol 5.6 石灰石或生石灰 2:3
【解析】
(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水;该反应中Cu化合价升高,作为还原剂,发生氧化反应;H2SO4中S元素化合价由+6价下降到+4价,得到2个电子,1mol H2SO4反应得到2mol电子;
(2)pH< 5.6的雨称为酸雨,石灰石或生石灰可以和二氧化硫反应,故向煤中加入适量的石灰石或生石灰可大大减少燃烧产物中二氧化硫的含量;
(3)通过反应Fe+2Fe3+=3Fe2+中对应关系,计算已反应的Fe3+和未反应的Fe3+的物质的量之比。
(1)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;该反应中Cu化合价升高,作为还原剂,发生氧化反应;H2SO4中S元素化合价由+6价下降到+4价,得到2个电子,1mol H2SO4反应得到2mol电子;故答案为:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O;该反应中Cu化合价升高,作为还原剂,发生氧化反应;H2SO4中S元素化合价由+6价下降到+4价,得到2个电子,1mol H2SO4反应得到2mol电子;故答案为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;Cu;2mol;
CuSO4+SO2↑+2H2O;Cu;2mol;
(2) pH< 5.6的雨称为酸雨,石灰石或生石灰可以和二氧化硫反应,故向煤中加入适量的石灰石或生石灰可大大减少燃烧产物中二氧化硫的含量,故答案为:5.6;石灰石或生石灰;
(3)设已反应的Fe3+的物质的量为2mol,则:
Fe+2Fe3+=3Fe2+
2mol 3mol
溶液中Fe2+的物质的量为3mol,溶液中的Fe3+和Fe2+浓度相等,所以未反应的Fe3+的物质的量为3mol,则已反应的Fe3+和未反应的Fe3+的物质的量之比为2mol:3mol=2:3,故答案为:2:3。

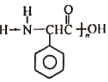
【题目】(1)葡萄酒中SO2最大使用量为0.25 g·L-1,取300.00 mL葡萄酒,通过适当的方法使 所含SO2全部逸出并用H2O2将其全部氧化为H2SO4,然后用0.090 0 mol·L-1NaOH标准溶液进行滴定。
①滴定前排气泡时,应选择下图中的________(填序号)。
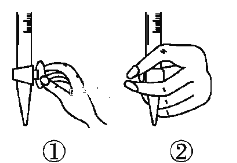
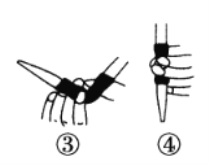
②若用50 mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积___(填序号)。
①=10 mL ②=40 mL ③<10 mL ④>40 mL。
③上述滴定实验中,可选择___为指示剂,选择该指示剂时如何判断反应到达滴定终点:_____。
④滴定终点读数时俯视刻度线,则测量结果比实际值________(填“偏高”、“偏低”或“无影响”)。
(2)某学生用0.100molL-1的KOH标准溶液滴定未知浓度的盐酸,其操作为:
A.移取20mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞;
B.用标准溶液润洗滴定管2~3次;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴处充满溶液;
D.取标准KOH溶液注入碱式滴定管至刻度“0”以上2~3cm 处;
E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管下面,用标准KOH溶液滴定至终点并记下刻度。
实验编号 | KOH溶液的浓度(mol/L) | 滴定完成时,KOH溶液滴入的体积(mL) | 待测盐酸溶液的体积(mL) |
1 | 0.10 | 22.62 | 20.00 |
2 | 0.10 | 22.72 | 20.00 |
3 | 0.10 | 22.80 | 20.00 |
①正确操作步骤的顺序是(用序号字母填写)___________________________
②根据上述数据,可计算出该盐酸的浓度约为______________(保留两位有效数字)。