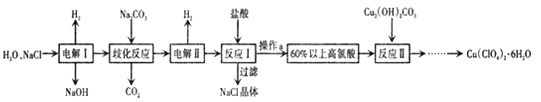
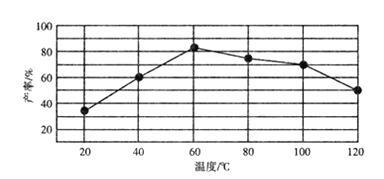
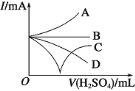
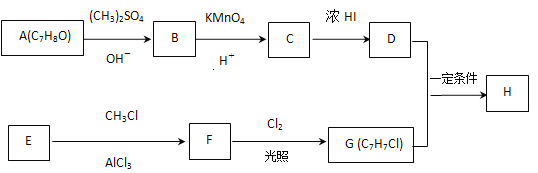
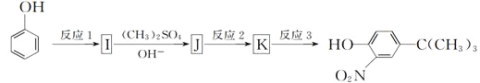
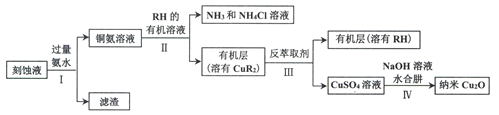
0 198029 198037 198043 198047 198053 198055 198059 198065 198067 198073 198079 198083 198085 198089 198095 198097 198103 198107 198109 198113 198115 198119 198121 198123 198124 198125 198127 198128 198129 198131 198133 198137 198139 198143 198145 198149 198155 198157 198163 198167 198169 198173 198179 198185 198187 198193 198197 198199 198205 198209 198215 198223 203614