题目内容
【题目】二甲醚(CH3OCH3)是一种清洁能源。工业上,常利用CO2和H2合成二甲醚。有关反应如下(z、y、z均大于0):
①2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-ykJ·mol-1
CO2(g)+H2(g) ΔH2=-ykJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
(1)2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=____kJ·mol-1。
CH3OCH3(g)+3H2O(g)ΔH=____kJ·mol-1。
(2)下列有关合成二甲醚的说法正确的是___(填字母)。
a.增大压强能提高反应速率和CO2的平衡转化率
b.体系中减小![]() ,平衡一定向正方向移动
,平衡一定向正方向移动
c.容器体积一定,混合气体密度不变时一定达到平衡状态
d.充入适量CO,可能提高CH3OCH3的产率
(3)在一定温度下,在恒容密闭容器中发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,
CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,升高温度,![]() 将___(选填“增大”“减小”或“不变”)。
将___(选填“增大”“减小”或“不变”)。
(4)在恒容密闭容器中用CO2和H2合成二甲醚时CO2的平衡转化率与温度、投料比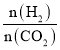 的关系如图所示。
的关系如图所示。
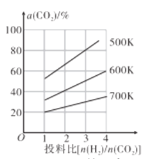
①500K时,将9molH2和3molCO2充入2L恒容密闭容器中,5min时反应达到平衡状态,则0~5min内的平均反应速率v(H2)=___molL-1min-l,该温度下,反应的平衡常数K=____(列出计算式即可,无需化简)。
②由图像可以得出的结论是___(答两条)。
(5)工业上也可用CO和H2合成二甲醚,而且二者还能作燃料电池的燃料。以CO、H2体积比为1∶2的混合气体与空气在KOH溶液中构成燃料电池(以石墨为电极),开始时,负极的电极反应式为___。
【答案】-(x+2z) ad 减小 0.72 ![]() 投料比不变,升高温度CO2的平衡转化率降低,温度不变,
投料比不变,升高温度CO2的平衡转化率降低,温度不变,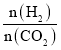 投料比越大,CO2的平衡转化率越大 CO+2H2–6e-+8OH-=CO32-+6H2O
投料比越大,CO2的平衡转化率越大 CO+2H2–6e-+8OH-=CO32-+6H2O
【解析】
(1)①2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
CH3OCH3(g)+H2O(g) ΔH1=-xkJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-ykJ·mol-1
CO2(g)+H2(g) ΔH2=-ykJ·mol-1
③CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
CH3OH(g)+H2O(g) ΔH3=-zkJ·mol-1
根据盖斯定律可知①+2×③可得:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)ΔH=△H1+△H3=-(x+2z)kJ·mol-1。故答案为:-(x+2z);
CH3OCH3(g)+3H2O(g)ΔH=△H1+△H3=-(x+2z)kJ·mol-1。故答案为:-(x+2z);
(2)a.合成二甲醚的反应为气体体积减小的反应,所以增大压强可以提高反应速率同时使平衡正向移动,提高CO2的平衡转化率,故a正确;
b.若分离出CO2使体系中减小![]() ,平衡逆向移动,故b错误;
,平衡逆向移动,故b错误;
c.容器体积不变,且反应物和生成物均为气体,则平衡移动过程中气体的质量不变,所以混合气体的密度一直不变,不能根据密度不变判断是否达到平衡,故c错误;
d.反应②平衡右移增大CO2的量,促使反应③正向移动,提高二甲醚的产率,故d正确;
故答案为:ad;
(3)在一定温度下,在恒容密闭容器中发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,正、逆反应速率相等,即k正c(CO)·c(H2O)=k逆c(CO2)·c(H2O),可得
CO2(g)+H2(g),速率表达式为v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2)(其中,k正、k逆为正、逆速率常数,与浓度无关)。达到平衡时,正、逆反应速率相等,即k正c(CO)·c(H2O)=k逆c(CO2)·c(H2O),可得![]() =K(平衡常数),该反应正反应为放热反应,升高温度平衡逆向移动,平衡常数减小。
=K(平衡常数),该反应正反应为放热反应,升高温度平衡逆向移动,平衡常数减小。
故答案为:减小;
(4)①500K、投料比等于3时,CO2的平衡转化率为80%,容器体积为2L,则在该时间段内二氧化碳的平均反应速率为v=![]() =0.24mol·L-1·min-1,同一反应同一时段内不同物质反应速率之比等于计量数之比,所以v(H2)=3v(CO2)=0.72 mol·L-1·min-1;
=0.24mol·L-1·min-1,同一反应同一时段内不同物质反应速率之比等于计量数之比,所以v(H2)=3v(CO2)=0.72 mol·L-1·min-1;
列三段式有:
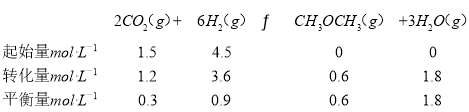
平衡常数K=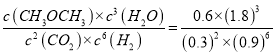 。
。
故答案为:0.72;![]() ;
;
②由图像可以得出的结论是投料比不变,升高温度CO2的平衡转化率降低,温度不变, 投料比越大,CO2的平衡转化率越大(答两条)。
投料比越大,CO2的平衡转化率越大(答两条)。
故答案为:投料比不变,升高温度CO2的平衡转化率降低,温度不变, 投料比越大,CO2的平衡转化率越大;
投料比越大,CO2的平衡转化率越大;
(5)CO和H2在反应过程中被氧化,所以在负极区充入,以CO、H2体积比为1∶2的混合气体与空气在KOH溶液中构成燃料电池(以石墨为电极),开始时,负极的电极反应式为CO+2H2–6e-+8OH-=CO32-+6H2O。
故答案为:CO+2H2–6e-+8OH-=CO32-+6H2O。

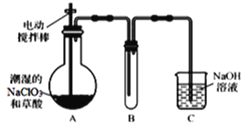
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
浓度(mol/L) | 体积/mL | 浓度(mol/L) | 体积/mL | ||
① | 0.10 | 2.0 | 0.01 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.01 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为:n(H2C2O4)∶n(KMnO4) ______________。
(2)探究温度对化学反应速率影响的实验编号是_______ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ________.
(3)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=_______。