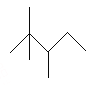
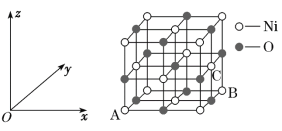
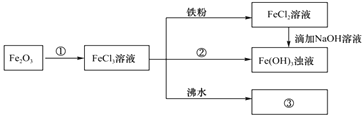
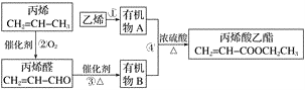
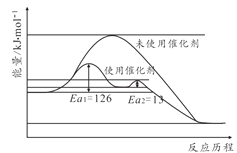
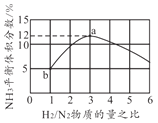
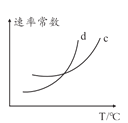
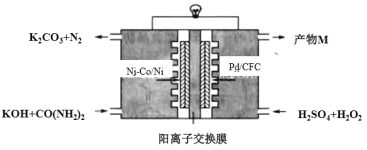
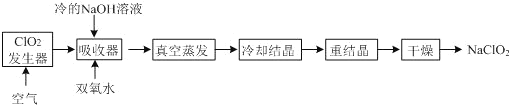
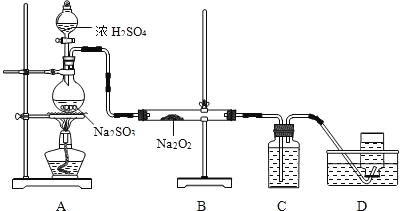
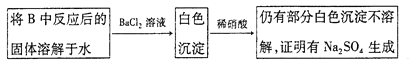
0 197988 197996 198002 198006 198012 198014 198018 198024 198026 198032 198038 198042 198044 198048 198054 198056 198062 198066 198068 198072 198074 198078 198080 198082 198083 198084 198086 198087 198088 198090 198092 198096 198098 198102 198104 198108 198114 198116 198122 198126 198128 198132 198138 198144 198146 198152 198156 198158 198164 198168 198174 198182 203614