题目内容
【题目】NaClO2的漂白能力是漂白粉的45倍,NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:
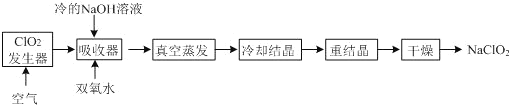
(1)吸收器中反应的离子方程式为________,吸收器中的反应温度不能过高,可能的原因_______。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的:________。
(3) ClO2发生器中的反应为2NaClO3+SO2+H2SO4═2ClO2+2NaHSO4,实际工业生产中可用硫磺、浓硫酸代替反应原料中的SO2,其原因是______(用化学方程式表示)。
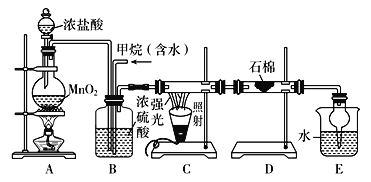
(4)某化学兴趣小组用如图所示装置制备SO2并探究SO2与Na2O2的反应:
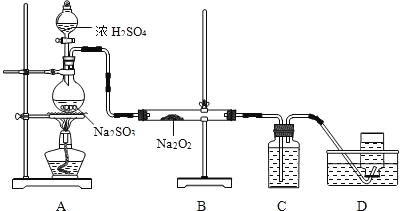
①为除去过量的SO2,C中盛放的试剂为______________。
②D中收集到的气体可使带余烬的木条复燃,B中硬质玻璃管内发生反应的化学方程式为_______。
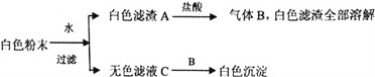
③有同学认为B中硬质玻璃管内可能还有NaSO4生成。为检验是否有 Na2SO4生成,他们设计了如下方案:
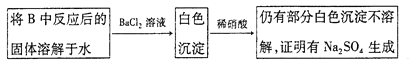
同学们经过讨论,认为上述方案不合理,其理由是:a____________;b_______________。
【答案】ClO2+2OH-+H2O2=2ClO2-+O2+2H2O 防止H2O2分解 驱赶出ClO2,确保其被充分吸收 S+2H2SO4(浓)![]() 3SO2↑+2H2O NaOH溶液(或KMnO4溶液) 2H2O2+2SO2=2Na2SO3+O2 稀硝酸能将亚硫酸钡氧化为硫酸钡 如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
3SO2↑+2H2O NaOH溶液(或KMnO4溶液) 2H2O2+2SO2=2Na2SO3+O2 稀硝酸能将亚硫酸钡氧化为硫酸钡 如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根
【解析】
(1)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,根据电荷守恒和元素守恒可写出离子方程式,升高温度H2O2分解速率加快,据此分析解答;
(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收;
(3)硫磺、浓硫酸可以反应生成二氧化硫;
(4)①二氧化硫是酸性氧化物,具有较强的还原性,据此选择试剂;②D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,据此分析判断;③根据硝酸、Na2O2氧化性均很强,均能将SO32-氧化成SO42-分析判断。
(1)吸收器中双氧水与ClO2在碱性条件下发生氧化还原反应生成NaClO2,反应的离子方程式为2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O;为了防止H2O2分解,反应温度不能过高,故答案为:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O;防止H2O2分解;
(2)反应结束后,发生器中仍有少量ClO2,用空气可以将其排出,确保其被充分吸收,故答案为:驱赶出ClO2,确保其被充分吸收;
(3)ClO2发生器中的反应为氯酸钠与二氧化硫在浓硫酸作用下发生氧化还原反应,而硫磺、浓硫酸也可以生成二氧化硫,反应的方程式为S+2H2SO4(浓)![]() 3SO2↑+2H2O,所以可用硫磺、浓硫酸代替原料中的SO2,故答案为:S+2H2SO4(浓)
3SO2↑+2H2O,所以可用硫磺、浓硫酸代替原料中的SO2,故答案为:S+2H2SO4(浓)![]() 3SO2↑+2H2O;
3SO2↑+2H2O;
(4)①二氧化硫是酸性氧化物,具有较强的还原性,能与氢氧化钠溶液或高锰酸钾溶液反应,所以C中盛放的试剂可以为NaOH溶液或KMnO4溶液,故答案为:NaOH溶液(或KMnO4溶液);
②D中收集到的气体可使带余烬的木条复燃,说明有氧气产生,所以B中发生的反应可能为二氧化硫与过氧化钠反应生成亚硫酸钠和氧气,反应的方程式为2Na2O2+2SO2=2Na2SO3+O2,故答案为:2Na2O2+2SO2=2Na2SO3+O2;
③反应后的固体溶解于水![]() 白色沉淀
白色沉淀![]() 仍有部分白色沉淀不溶解,不能证明有Na2SO4生成,因为:a.稀硝酸能将亚硫酸钡氧化为硫酸钡;b.如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根离子氧化成硫酸根离子,因此方案不合理,故答案为:稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根。
仍有部分白色沉淀不溶解,不能证明有Na2SO4生成,因为:a.稀硝酸能将亚硫酸钡氧化为硫酸钡;b.如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根离子氧化成硫酸根离子,因此方案不合理,故答案为:稀硝酸能将亚硫酸钡氧化为硫酸钡;如果反应后的固体中还残留Na2O2,它溶于水后能将亚硫酸根氧化成硫酸根。

 阅读快车系列答案
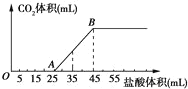
阅读快车系列答案【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1