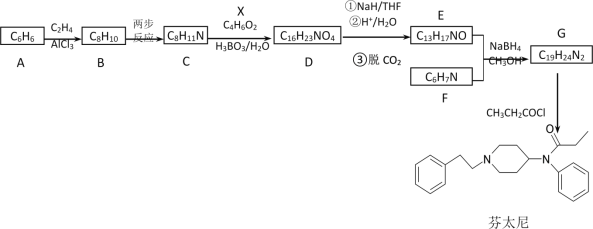
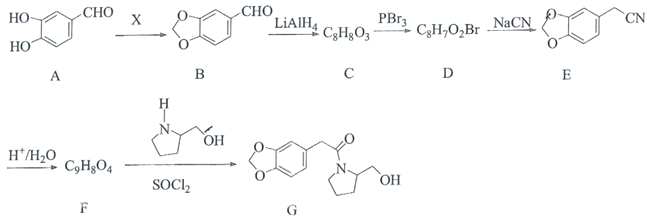
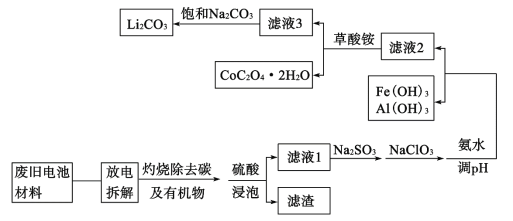
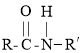题目内容
【题目】Fe、Co、Ni均为第Ⅷ族元素,它们的化合物在生产、生活中有着广泛的应用。
(1)基态Fe原子中,电子填充的能量最高的能级符号为__。
(2)在空气中FeO稳定性小于Fe2O3,从电子排布的角度分析,其主要原因是__。
(3)铁氰化钾{K3[Fe(CN)6])}溶液是检验Fe2+常用的试剂。lmol[Fe(CN)6]3-含σ键的数目为__。
(4)Co3+的一种配离子[Co(N3)(NH3)5]2+中,Co3+的配位数是__。配体N3-中心原子的杂化类型为__。CoO的熔点是1935℃,CoS的熔点是1135℃,试分析CoO的熔点较高的原因__。
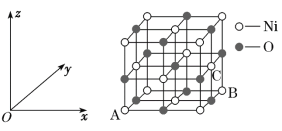
(5)NiO的晶胞结构如图所示,其中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为__。
【答案】3d Fe2+中3d轨道没有达到半充满的稳定结构,而Fe3+中3d轨道达到半充满的稳定结构 12NA 6 sp 两者均为离子晶体,但S2-半径大于O2-半径,CoO的晶格能大于CoS,因此CoO的熔点较高 (1,![]() ,
,![]() )
)
【解析】
(1)铁的原子序数为26,价电子排布式为3d64s2;
(2)氧化亚铁中亚铁离子的价电子排布式为3d6,3d轨道没有达到半充满的稳定结构,氧化铁中铁离子的价电子排布式为3d5,3d轨道达到半充满的稳定结构;
(3)在配合物Fe(CN)63-中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键;
(4)[Co(N3)(NH3)5]2+中,Co3+为中心离子,N3-和NH3为配位体;配体N3-与二氧化碳的原子个数和价电子数相同,属于等电子体,等电子体具有相同的空间结构;CoO和CoS均为离子晶体,但S2-半径大于O2-半径;
(5)已知晶胞中原子坐标参数A为(0,0,0),B的原子坐标分别为(1,1,0),则以A为晶胞坐标原点,晶胞的边长为1,C原子在晶胞立方体的面心上。
(1)铁的原子序数为26,价电子排布式为3d64s2,由构造原理可知能量最高的能级为3d,故答案为:3d;
(2)氧化亚铁中亚铁离子的价电子排布式为3d6,3d轨道没有达到半充满的稳定结构,氧化铁中铁离子的价电子排布式为3d5,3d轨道达到半充满的稳定结构,所以在空气中FeO稳定性小于Fe2O3,故答案为:Fe2+中3d轨道没有达到半充满的稳定结构,而Fe3+中3d轨道达到半充满的稳定结构;
(3)在配合物Fe(CN)63-中,CN-与铁离子之间有6个配位键,在每个CN-内部有一个共价键,所以1mol该配合物中含有σ键的数目为12NA,故答案为:12NA;
(4)[Co(N3)(NH3)5]2+中,Co3+为中心离子,N3-和NH3为配位体,配位数为6;配体N3-与二氧化碳的原子个数和价电子数相同,属于等电子体,等电子体具有相同的空间结构,二氧化碳的空间构型为直线形,则N3-离子的空间构型也为直线形,由空间构型可知N原子的杂化方式为sp杂化;CoO和CoS均为离子晶体,但S2-半径大于O2-半径,CoO的晶格能大于CoS,因此CoO的熔点较高,故答案为:两者均为离子晶体,但S2-半径大于O2-半径,CoO的晶格能大于CoS,因此CoO的熔点较高;
(5)已知晶胞中原子坐标参数A为(0,0,0),B的原子坐标分别为(1,1,0),则以A为晶胞坐标原点,晶胞的边长为1,C原子在晶胞立方体的面心上,则C原子坐标参数为(1,![]() ,
,![]() ),故答案为:(1,
),故答案为:(1,![]() ,
,![]() )。
)。

【题目】下表是元素周期表的一部分,请用化学用语回答有关问题:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
(1)⑥的氢氧化物中,所含化学键的类型是______。
(2)①和④可形成化合物,用电子式表示其形成过程______。
(3)⑦的最高价氧化物的水化物与⑧的最高价氧化物的水化物反应的离子方程式为_____。
(4)研究物质的性质差异性是学习的重要方法之一。②、③、⑧、⑨四种元素的最高价氧化物的水化物中,化学性质明显不同于其它三种酸的是______。
(5)能说明元素⑤的非金属性强于元素⑨的非金属性的实验事实是_____(填字母)。
A.两种单质的熔沸点不同
B.两种单质与氢气化合的难易程度
C.比较这两种元素的最高价氧化物的水化物的酸性