【题目】某小组在实验室使用软锰矿(主要成分为MnO2)和浓盐酸通过加热制备氯气,并对氯气的性质进行探究。
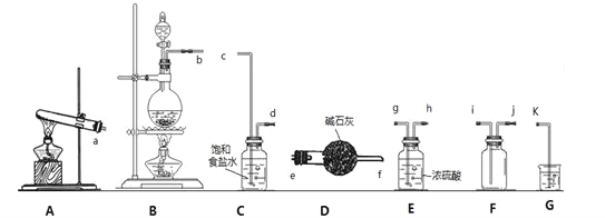
(1)写出实验室制氯气的化学方程式:__。欲制取并收集一瓶于燥的氯气,则“制取→收集”的实验装置连接顺序为__→c→d→__→i→j→k。
(2)装置C中饱和食盐水的作用是___。
(3)该小组同学对氯气性质进行如下探究:
实验步聚 | 实验结论 |
①将氯气通入NaCl溶液中,再加入1mLCCl4振荡,静置,观察四氢化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
②将氯气通入KBr溶流中,再加入1mLCCl4振落,静置,观察四氯化碳层颜色 | |
③将氯气通入KI溶液中,再加入1mLCCl4振荡,静置,观察四氧化碳层颜色 |
该小组的实验设计缺陷是___,改进的办法是__。
(4)常温下,高锰酸钾固体和浓盐酸反应也可制得氯气,该反应的离子方程式为:___。
(5)某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的质量之比为__。