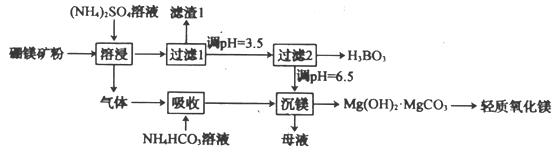
题目内容
【题目】氯化亚铜(CuCI)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、H+、CI-)中制备氯化亚铜。

请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式:___。
(2)步骤②的操作名称是___。
(3)步骤④中所加物质X为___。
(4)步骤⑤的操作是___。
(5)步骤⑥应调节溶液的pH呈酸性,且用乙醇洗涤CuCl品体,目的是___。
(6)在CuCI的生成过程中,可以循环利用的物质是___,理论上___(填“需要”或“不需要”)补充(不考虑调节等消耗);理由是___。
(7)エ业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应:___。
【答案】Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+或Fe+2H+=Fe2++H2↑ 过滤、洗涤 CuO或Cu(OH)2或CuCO3等 在HCl气流中蒸发结晶 减少CuCl的损失 硫酸 不需要 Cu与浓硫酸反应生成CuSO4和SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4 Cu2++Cl-+e-=CuCl↓
【解析】
从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-)中制备氯化亚铜,向工业上以某酸性废液(含Cu2+、Fe3+、H+、Cl-)加入过量的铁粉,三价铁离子与铁粉反应转化为二价铁离子,铜离子与铁反应生成铜,然后过滤,滤渣为过量的铁和生成的铜,依据铜与铁活泼性,将滤渣溶于盐酸,铜与盐酸不反应,过滤得到滤渣即为铜,然后铜与浓硫酸反应生成硫酸铜和二氧化硫,酸性废液调节pH值使铁离子沉淀,过滤得氯化铜溶液,氯化铜、硫酸铜、二氧化硫反应生成氯化亚铜和硫酸,硫酸可以再循环利用。
(1)步骤①中铁能与铜离子及铁离子反应生成铜和亚铁离子等,同时铁也与酸性废液中的酸反应生成氢气,涉及的离子方程式为Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+、Fe+2H+=Fe2++H2↑,故答案为:Cu2++Fe=Cu+Fe2+、Fe+2Fe3+=3Fe2+或Fe+2H+=Fe2++H2↑;
(2)步骤②中从溶液中分离出固体物质过量的铁和生成的铜,所以步骤②的操作名称是过滤、洗涤,故答案为:过滤、洗涤;
(3)步骤④中为调节溶液的pH值,要能与酸反应同时不引入新的杂质,所以物质X为CuO或Cu(OH)2或CuCO3等,故答案为:CuO或Cu(OH)2或CuCO3等;
(4)步骤⑤的操作是从氯化铜溶液中获得氯化铜晶体,要防止铜离子水解,所以步骤⑤的操作是在HCl气流中蒸发结晶,故答案为:在HCl气流中蒸发结晶;
(5)CuCl微溶于水、不溶于乙醇及稀硫酸,所以要用乙醇洗涤CuCl晶体,减少CuCl的损失,故答案为:减少CuCl的损失;
(6)根据流程分析可知,硫酸可以循环利用,Cu与浓硫酸反应生成CuSO4和SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4,故答案为:硫酸;不需要;Cu与浓硫酸反应生成CuSO4和SO2的物质的量为1:1,而生产CuCl的过程中消耗CuSO4和SO2的物质的量也为1﹕1,所以理论上不需要补充H2SO4;
(7)电解CuCl2溶液,阴极上是铜离子得电子生成亚铜离子,亚铜离子结合氯离子生成氯化亚铜沉淀,电极反应式为 Cu2++Cl-+e-=CuCl↓,故答案为:Cu2++Cl-+e-=CuCl↓。

 阅读快车系列答案
阅读快车系列答案