��Ŀ����
����Ŀ��ijС����ʵ����ʹ�����̿���Ҫ�ɷ�ΪMnO2����Ũ����ͨ�������Ʊ��������������������ʽ���̽����
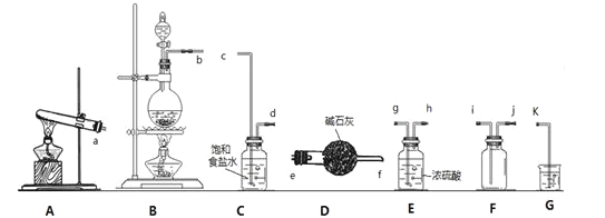
��1��д��ʵ�����������Ļ�ѧ����ʽ��__������ȡ���ռ�һƿ�����������������ȡ���ռ�����ʵ��װ������˳��Ϊ__��c��d��__��i��j��k��
��2��װ��C�б���ʳ��ˮ��������___��
��3����С��ͬѧ���������ʽ�������̽����
ʵ�鲽�� | ʵ����� |
�ٽ�����ͨ��NaCl��Һ�У��ټ���1mLCCl4�����ã��۲����⻯̼����ɫ | �����Դ�ǿ������˳���ȡ��塢�� |
�ڽ�����ͨ��KBr�����У��ټ���1mLCCl4���䣬���ã��۲����Ȼ�̼����ɫ | |
�۽�����ͨ��KI��Һ�У��ټ���1mLCCl4�����ã��۲�������̼����ɫ |
��С���ʵ�����ȱ����___���Ľ��İ취��__��
��4�������£�������ع����Ũ���ᷴӦҲ���Ƶ��������÷�Ӧ�����ӷ���ʽΪ��___��
��5��ij�¶��£���Cl2ͨ��NaOH��Һ�У���Ӧ�õ�NaCl��NaClO��NaClO3�Ļ��Һ�����ⶨClO-��ClO3-��Ũ��֮��Ϊ1��3����Cl2��NaOH��Һ��Ӧʱ����ԭ����Ԫ���뱻��������Ԫ�ص�����֮��Ϊ__��
���𰸡�MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O b g��h ��ȥCl2�е�HCl���� ����֤�����������ǿ�ڵ� ����һ��ʵ�飬����Ϊ��Kl ��Һ�У�������ˮ���ټ���1mLCCl4�����ã��۲�CCl4����ɫ 2KMnO4+16H++10C1-=2K++2Mn2+5Cl2��+8H2O 4��1
MnCl2+Cl2��+2H2O b g��h ��ȥCl2�е�HCl���� ����֤�����������ǿ�ڵ� ����һ��ʵ�飬����Ϊ��Kl ��Һ�У�������ˮ���ټ���1mLCCl4�����ã��۲�CCl4����ɫ 2KMnO4+16H++10C1-=2K++2Mn2+5Cl2��+8H2O 4��1
��������
Ũ����Ͷ������̻�ϼ����������������Ȼ��̺�ˮ���ɵ����غ㡢ԭ���غ㼴��д��������Ӧ�Ļ�ѧ����ʽ��ʵ�����ö������̺�Ũ������ȷ�����ȡ�������Ʊ��������к����Ȼ����ˮ����������ͨ��ʢ�б���ʳ��ˮ��Ũ����ϴ��ƿ��ȥ���ʣ������ܶȴ��ڿ����ܶȣ��������Ŀ������ռ���β��������������Һ���գ��ݴ˷�����
��1�����ö������̺�Ũ�����ϼ�����������������Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��ʵ�����ö������̺�Ũ������ȷ�����ȡ�������Ʊ��������к����Ȼ����ˮ����������ͨ��ʢ�б���ʳ��ˮ��Ũ����ϴ��ƿ��ȥ���ʣ������ܶȴ��ڿ����ܶȣ��������Ŀ������ռ���β��������������Һ���գ�������ȷ������˳��Ϊ��b��c��d��g��h��i��j��k���ʴ�Ϊ��MnO2+4HCl��Ũ��
MnCl2+Cl2��+2H2O��ʵ�����ö������̺�Ũ������ȷ�����ȡ�������Ʊ��������к����Ȼ����ˮ����������ͨ��ʢ�б���ʳ��ˮ��Ũ����ϴ��ƿ��ȥ���ʣ������ܶȴ��ڿ����ܶȣ��������Ŀ������ռ���β��������������Һ���գ�������ȷ������˳��Ϊ��b��c��d��g��h��i��j��k���ʴ�Ϊ��MnO2+4HCl��Ũ��![]() MnCl2+Cl2��+2H2O��b��g��h��
MnCl2+Cl2��+2H2O��b��g��h��
��2��װ��C�б���ʳ��ˮ�������dz�ȥCl2�е�HCl���ʣ��ʴ�Ϊ����ȥCl2�е�HCl���ʣ�
��3��ʵ��ڵó������������Դ���Br2����ʵ��۵ó������������Դ���I2������ȷ��Br2�������Դ���I2��Ӧ����һ��ʵ�飬����Ϊ��Kl ��Һ�У�������ˮ���ټ���1mLCCl4�����ã��۲�CCl4����ɫ��ȷ��Br2����������I2��������ǿ�����ʴ�Ϊ������֤�����������ǿ�ڵ⣻����һ��ʵ�飬����Ϊ��Kl ��Һ�У�������ˮ���ټ���1mLCCl4�����ã��۲�CCl4����ɫ��
��4�������£����ø�����ع����Ũ���ᷴӦҲ����������������Ӧ�Ļ�ѧ����ʽΪ2KMnO4+16HCl(Ũ)=2MnCl2+5Cl2��+2KCl+8 H2O����÷�Ӧ�����ӷ���ʽΪ2KMnO4+16H++10C1-=2K++2Mn2+5Cl2��+8H2O���ʴ�Ϊ��2KMnO4+16H++10C1-=2K++2Mn2++5Cl2��+8H2O��
��5������ClO-��ClO3-��Ũ��֮��1��3����Cl��ClO-��ʧȥ1�����ӣ���Cl��ClO3-��ʧȥ5�����ӣ�һ��ʧȥ1+3��5=16�����ӣ���Cl��Cl-���õ�1�����ӣ���Ҫ16��ԭ�Ӳ��ܵõ�16�����ӣ����ԣ�����ԭ����Ԫ���뱻��������Ԫ�ص����ʵ���֮��=16����1+3��=4��1���ʴ�Ϊ��4��1��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�

