题目内容
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下,则下列判断正确的是( )
![]()
A.MFe2Ox是氧化剂
B.SO2是该反应的催化剂
C.x<y
D.MFe2Oy是还原产物
【答案】C
【解析】
A.SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,故A错误;
B.SO2在反应中转化为S为氧化剂,不是催化剂,故B错误;
C.MFe2Ox为还原剂生成MFe2Oy,反应后Fe元素的化合价升高,根据化合价代数和,则有(2y-2)>(2x-2),即x<y,故C正确;
D.SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,所以MFe2Oy是氧化产物,故D错误;
故选C。
【点晴】
本题主要考查学生根据题目所给的信息和所学的化学知识进行解题的能力,解答时注意根据化合价的变化和化合物化合价代数和为0分析解答问题,要细心分析。在反应中,SO2转化为S,S元素化合价降低,说明SO2在反应中为氧化剂,则MFe2Ox为还原剂,反应后Fe元素的化合价升高,根据Fe元素常见化合价为+2、+3价判断x、y大小关系。

 阅读快车系列答案
阅读快车系列答案【题目】在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)t℃时,关于N2、NH3的两个反应的信息如下表所示:
化学反应 | 正反应活化能 | 逆反应活化能 | t℃时平衡常数 |
N2(g)+O2(g)=2NO(g) △H>0 | a kJ/mol | b kJ/mol | K1 |
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H<0 | c kJ/mol | d kJ/mol | K2 |
请写出t℃时氨气被一氧化氮氧化生成无毒气体的热化学方程式:______________________,t℃时该反应的平衡常数为__________ (用K1和K2表示)。
(2)工业合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
2NH3(g)下图甲表示在一定体积的密闭容器中反应时,H2的物质的量浓度随时间的变化。图乙表示在其他条件不变的情况下,起始投料H2与N2的物质的量之比(设为x)与平衡时NH3的物质的量分数的关系。
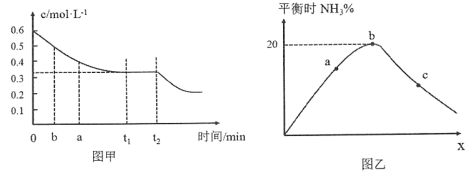
①图甲中0~t1 min内,v(N2)=_____mol·L-1·min-1;b点的v(H2)正_____a点的v(H2)逆(填“大于”“小于”或“等于”)。
②己知某温度下该反应达平衡时各物质均为1 mol,容器体积为1L,保持温度和压强不变,又充入3 mol N2后,平衡________(填“向右移动”“向左移动”或“不移动”)。
(3)①科学家研究出以尿素为动力的燃料电池新技术。用这种电池可直接去除城市废水中的尿素,既能产生净化的水,又能发电。尿素燃料电池结构如图所示,写出负极电极反应式:________________________________________________。
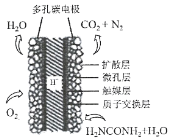
②理论上电池工作时,每消耗标准状况下2.24 L O2时,可产生的电量为________ (法拉第常数为96500C/ mol)。
【题目】氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为0.1mol/L的4种钠盐溶液pH如表:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中,正确的是( )
A. 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度
B. 四种溶液中,水的电离程度最大的是NaClO
C. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最大的是H2SO3
D. NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>c(OH-)







