题目内容
【题目】下列说法正确的是( )
A. 常温下,将pH=3的醋酸溶液加水稀释到原体积的10倍后,溶液的pH=4
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
D. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-)
【答案】D
【解析】
A.醋酸是弱电解质,加水稀释促进醋酸电离,则常温下将pH=3的醋酸溶液稀释到原体积的10倍后,氢离子浓度大于原来的![]() ,所以稀释后溶液的pH<4,故A错误;
,所以稀释后溶液的pH<4,故A错误;
B.NaHA溶液的pH>7说明H2A的二级电离是不完全电离,可以说明H2A是弱酸,NaHA溶液的pH<7,H2A是强酸或弱酸都有可能,如硫酸、亚硫酸等,故B错误;
C.常温下pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后,醋酸过量,混合溶液呈酸性,则所得溶液的pH<7,故C错误;
D. 向氨水中逐滴滴入盐酸至溶液的pH=7,c(H+)= c(OH-),由电荷守恒知c(NH4+)+c(H+)= c(OH-)+ c(Cl-),则c(NH4+) = c(Cl-),故D正确;
答案选D。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
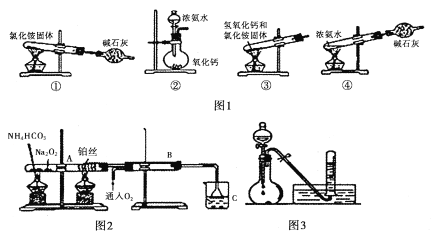
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置中提供的物质完成相关实验,最合理的选项是( )
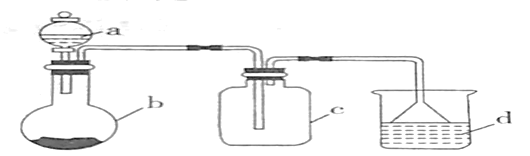
选项 | a中的溶液 | b中的物质 | c中收集的气体 | d中的液体 |
A | 浓氨水 | 生石灰 | NH3 | H2O |
B | 浓硝酸 | 铜片 | NO2 | H2O |
C | 稀硝酸 | 铜片 | NO | NaOH溶液 |
D | 浓硫酸 | 亚硫酸钠 | SO2 | NaOH溶液 |
A.AB.BC.CD.D