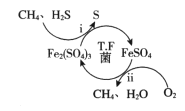
【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
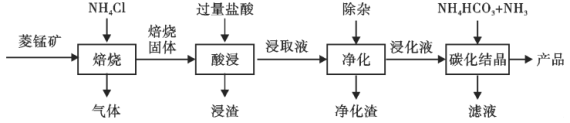
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
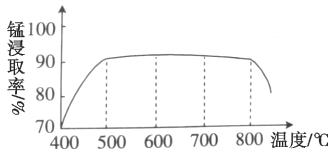
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。
【题目】培养学生的学科素养是高中化学新课程的总目标,探究式课堂的教学由于注重知识的形成过程而很好地体现了新课改的理念。某班在学习“过氧化钠的性质”时,做了如下两个实验:
实验一:向盛有少量Na2O2固体的试管中滴入一定量的水,立即把带火星的木条放在试管口,检验生成的气体。用手轻轻摸一下试管外壁,然后向反应后的溶液中滴入酚酞溶液。观察到木条复燃,管壁微热,加入酚酞后溶液变红,马上又褪色。
针对该实验过程,很多学生对反应原理及反应过程提出了许多问题,如为何溶液变红色又褪色,其原因是什么?实验现象也不能给予正确的解释,为解决此疑问,我们组织化学活动小组同学查阅了有关资料并做了一些实验加以探究。
Ⅰ.探究反应的原理:①Na2O2溶于水电离出Na+和O22- ,O22- 与H2O电离出的H+结合生成H2O2,②H2O2再分解释放出O2。
(1)请写出与该反应原理中的两个方程式:①__________________________②__________;
Ⅱ. 探究褪色的原理
通过资料查阅后,溶液先变红是因为生成NaOH,之后再褪色是因为H2O2的作用(已知H2O2具有氧化性,酸性)。化学活动小组的同学们猜想H2O2是如何使溶液褪色的,提出了两个假设。
(2)假设甲:反应生成的中间产物H2O2具有酸性,中和了NaOH使溶液褪色。
假设乙:___________________________________________________。
(3)为了验证这两个假设到底哪一个正确的,同学们设计了一组实验来研究这个问题。通过以下实验证明假设乙是正确的。
实验步骤 | 实验现象 | 实验结论 | |
实验1 | 取少量NaOH溶液于试管中,加 入酚酞溶液变红,再加入少量30% | ①______________ |
|
实验2 | 在实验1的溶液中加入适量的NaOH溶液 | ②______________ | 使红色褪去的原因是双氧水的氧化性 |
实验二:石棉网上面有一个棉花团(内含适量浅黄色固体粉末),点燃后,导出CO2气体吹向棉花团,发现棉花团剧烈燃烧。
(4)结合所学知识分析棉花团剧烈燃烧的原因主要是:_______________________________;
请写出相关的化学反应方程式:_____________________________________。
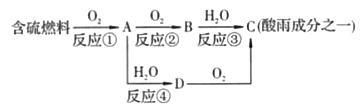
【题目】如图所示是酸雨的形成示意图。根据图示回答下列问题。
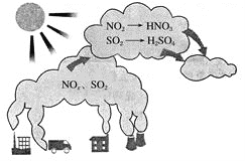
(1)下列气体容易形成酸雨的是_____。
A.CO2 B.SO2 C.N2 D.NO2
(2)现有雨水样品1份,每隔一段时间测定该雨水样品的pH,所得数据如下:
测试时间/h | 0 | 1 | 2 | 3 | 4 |
与水的pH | 4.73 | 4.63 | 4.56 | 4.55 | 4.55 |
分析数据,回答下列问题:
①雨水样品的pH变化的原因是____(用化学方程式表示)。
②如果将刚取样的上述雨水和自来水相混合,pH将变____,原因是_____(用化学方程式表示)。
(3)下列措施中,可减少酸雨产生的途径的是____(填字母)。
①少用煤作燃料 ②把工厂烟囱造高 ③燃料脱硫 ④在已酸化的土壤中加石灰 ⑤开发新能源
A.①②③ B.②③④⑤ C.①③⑤ D.①③④⑤