题目内容
【题目】氮的氧化物和硫的氧化物是导致酸雨的物质。
(1)形成酸雨的原理之一可简单表示如下:

回答下列问题:
①酸雨的pH________(填“>”“<”或“=”)5.6。
②D物质的化学式为____________。
③反应②的化学方程式为___________________________________。
(2)在一定条件下氨气亦可用来将氮氧化物转化为无污染的物质。写出氨气和二氧化氮在一定条件下反应的化学方程式:____________,反应中氧化剂是___________,还原剂是_______________。
(3)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
现有VL某NaOH溶液能完全吸收n mol NO2和m mol NO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为________mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=________。
【答案】< H2SO3 2SO2+O2![]() 2SO3 6NO2+8NH3
2SO3 6NO2+8NH3![]() 7N2+12H2O NO2 NH3 (m+n)/V 3∶2
7N2+12H2O NO2 NH3 (m+n)/V 3∶2
【解析】
(1)含硫燃料燃烧生成A为SO2,二氧化硫催化氧化生成SO3,三氧化硫溶于水生成C为H2SO4,反应④是二氧化硫和水反应生成D为亚硫酸,亚硫酸被空气中氧气氧化生成硫酸,据此解答;
(2)无污染的物质应该是氮气和水,即氨气和二氧化氮在一定条件下反应生成氮气和水,据此判断;
(3)①根据原子守恒计算;②根据反应的化学方程式结合原子守恒解答。
根据以上分析可知A为SO2,B为SO3,C为H2SO4,D为亚硫酸,则
(1)①酸雨是指溶液pH<5.6的雨水;
②分析可知D为亚硫酸,化学式为H2SO3;
③反应②是二氧化硫的催化氧化生成三氧化硫,反应的化学方程式为2SO2+O2![]() 2SO3;
2SO3;
(2)氨气和二氧化氮在一定条件下反应生成氮气和水,反应的化学方程式为6NO2+8NH3![]() 7N2+12H2O,反应中二氧化氮中氮元素化合价降低做氧化剂,氨气中氮元素化合价升高做还原剂;
7N2+12H2O,反应中二氧化氮中氮元素化合价降低做氧化剂,氨气中氮元素化合价升高做还原剂;
(3)①根据方程式可知硝酸钠或亚硝酸钠中钠原子和氮原子均满足个数之比是1:1,所以根据原子守恒可知消耗氢氧化钠的物质的量是(n+m)mol,则所用烧碱溶液的物质的量浓度至少为(n+m)mol÷VL=(m+n)/V mol·L-1。
②根据方程式NO2+NO+2NaOH=2NaNO2+H2O可知n mol NO消耗n mol NO2,剩余(m-n)mol NO2参与反应2NO2+2NaOH=NaNO2+NaNO3+H2O,所以有![]() ,解得n∶m=3∶2。
,解得n∶m=3∶2。

【题目】X、Y、Z 是中学化学中常见的三种物质,下表各组物质之间通过一步反应不能实现右图所示转化关系的是
X | Y | Z | 箭头上所标数字的反应条件 | ||
A. | NO | NO2 | HNO3 | ①常温遇氧气 |
|
B. | Cl2 | NaClO | HClO | ②通入CO2 | |
C. | Na2O2 | NaOH | NaCl | ③加入H2O2 | |
D. | Al2O3 | NaAlO2 | Al(OH)3 | ④加NaOH溶液 |
A. A B. B C. C D. D
【题目】I.常温下,将某一元酸HA和NaOH溶液等体积混合,分别进行编号为①、②、③的实验,实验数据记录如下表。
序号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)根据①组实验情况,分析混合溶液的pH=9的原因是______________________(用离子方程式表示),在该溶液中下列关系式错误的是________________(填标号)。
a.c(Na+)+c(H+)=c(OH-)+c(A-) b.c(Na+)=c(HA)+c(A-)
c.c(HA)+c(H+)=c(OH-) d.c(Na+)+c(H+)=c(OH-)+c(A-)+c(HA)
(2)②组情况表明,c______0.2(填“>”“<”或“=”,下同),混合溶液中:c(A-)_______c(Na+)。
(3)从③组实验结果分析,说明HA的电离程度_____NaA的水解程度(填“>”“<”或“=”),离子浓度由大到小的顺序是_______________________________。
Ⅱ.室温下,若将0.1 molL-1盐酸滴入20mL0.1 molL-1氨水中,溶液pH随加入盐酸体积的变化曲线如下图所示:
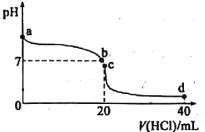
(1)NH3·H2O的电离方程式是_______________________________。
(2)b点所示溶液中的溶质是_______________________________。
(3)c点所示溶液中,离子浓度从大到小的关系为_______________________________。