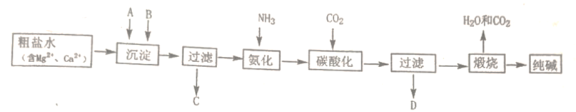
【题目】工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是946kJ·mol-1,则上述反应的ΔH=_________________。
(2)上述反应的平衡常数K的表达式为____________,若反应方程式改写为NH3(g)![]() N2(g)+
N2(g)+![]() H2(g),则平衡常数K1=____________________(用K表示)。
H2(g),则平衡常数K1=____________________(用K表示)。
(3)在773K时,分别将2mol N2和6mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | m | 1.80 | 1.98 | 2.00 | 2.00 |
①表格中m=_______________/span>,15~25min内,v(N2)=_______________。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度均为3mol·L-1,此时v正_______v逆(填“>”、“<”或“=”)。
③由表中的实验数据计算得到“浓度~时间”的关系可用图中的曲线表示,表示c(N2)~t的曲线是______________(填“甲”、“乙”或“丙”)。在此温度下,若起始充入4mol N2和12mol H2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为_________________。

(4)Marnellos和Stoukides采用电解法合成氨,实现了常压合成和氮气的高转化率。该方法用SCY陶瓷将两极隔开,SCY陶瓷具有高质子导电性,其作用是传导H+,则阴极的电极反应为____________________。
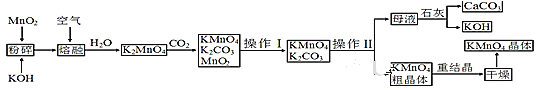
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
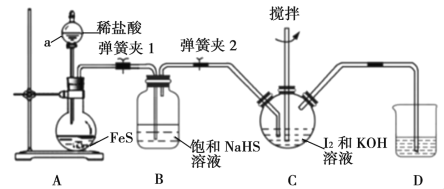
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_______。
②按气流由左到右的方向,上述仪器的连接顺序为____(填字母,装置可多次使用);C中盛放的试剂是_____。
③该制备装置的缺点为______。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
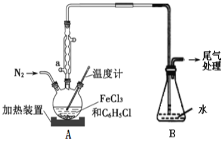
①仪器a的名称是____。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是__,回收滤液中C6H5C1的操作方法是____。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为______。