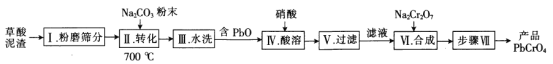
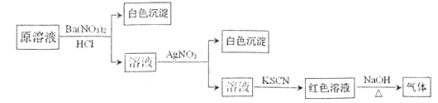
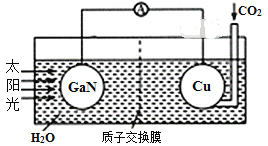
题目内容
【题目】纯碱是一种非常重要的化工原料,在玻璃、肥料、合成洗涤剂等工业中有着广泛的应用。工业上“候氏制碱法”以NaCl、NH3、CO2及水等为原料制备纯碱,其反应原理为:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。生产纯碱的工艺流程示意图如下:
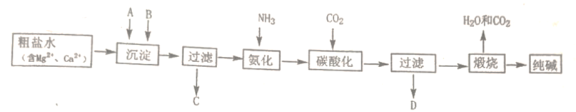
完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。A_____________,B_____________。
(2)碳酸化后过滤,滤液D最主要的成分是__________(填写化学式),检验这一成分的阴离子的具体方法是: ______。
(3)该工艺流程中可回收再利用的物质是_______。
(4)产品纯碱中含有碳酸氢钠,如果取m1 kg纯碱加热分解后剩余固体质量为m2 kg,纯碱中碳酸氢钠的质量分数可表示为:__________。
【答案】CaO Na2CO3 NH4Cl 取溶液少许于试管中,加入硝酸酸化的硝酸银,出现白色沉淀,说明溶液中有氯离子 CO2 ![]()
【解析】
根据除杂原则需先除去镁离子与钙离子,先加在氨化饱和的氯化钠溶液里通CO2气体,因碳酸氢钠的溶解度比碳酸钠小,有碳酸氢钠沉淀生成,经过滤、洗涤干燥后,再将碳酸氢钠加热分解可得纯碱,同时生成的CO2气体循环利用。
(1)粗盐水中有钙离子、镁离子,除去钙离子、镁离子,沉淀剂A来自石灰窑厂,则可知应为碳酸钙煅烧以后的生石灰,及CaO,可除去镁离子,再加入碳酸钠以除去过量的钙离子,
故答案为CaO; Na2CO3;
(2)碳酸化后过滤,有题意方程式NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl可知,滤液中有氯化铵,电离出氯离子,氯离子的检验方法是加入硝酸酸化的硝酸银,
故答案为NH4Cl;取溶液少许于试管中,加入硝酸酸化的硝酸银,出现白色沉淀,说明溶液中有氯离子;
(4)2NaHCO3=Na2CO3+H2O+CO2 加热损失的质量
168 106 168-106=62
x m1- m2
![]()
x=![]()
纯碱中碳酸氢钠的质量分数可表示为: ![]() ;
;
故答案为![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),对其研究如下:
2NH3(g),对其研究如下:
(1)已知H—H键能为436kJ·mol-1,N—H键能为391kJ·mol-1,N≡N键的键能是946kJ·mol-1,则上述反应的ΔH=_________________。
(2)上述反应的平衡常数K的表达式为____________,若反应方程式改写为NH3(g)![]() N2(g)+
N2(g)+![]() H2(g),则平衡常数K1=____________________(用K表示)。
H2(g),则平衡常数K1=____________________(用K表示)。
(3)在773K时,分别将2mol N2和6mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(NH3)与反应时间t的关系如下表:
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(NH3)/mol | 0 | 1.00 | m | 1.80 | 1.98 | 2.00 | 2.00 |
①表格中m=_______________/span>,15~25min内,v(N2)=_______________。
②该温度下,若向同容积的另一容器中投入的N2、H2、NH3浓度均为3mol·L-1,此时v正_______v逆(填“>”、“<”或“=”)。
③由表中的实验数据计算得到“浓度~时间”的关系可用图中的曲线表示,表示c(N2)~t的曲线是______________(填“甲”、“乙”或“丙”)。在此温度下,若起始充入4mol N2和12mol H2,反应刚达到平衡时,表示c(H2)的曲线上相应的点为_________________。

(4)Marnellos和Stoukides采用电解法合成氨,实现了常压合成和氮气的高转化率。该方法用SCY陶瓷将两极隔开,SCY陶瓷具有高质子导电性,其作用是传导H+,则阴极的电极反应为____________________。