题目内容
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯, 易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ||
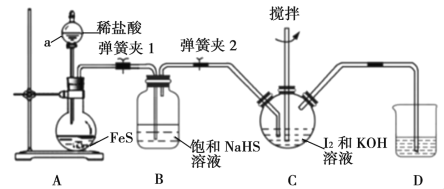
(1)用H2还原无水FeCl3制取FeCl2。有关装置如下:

①H2还原无水FeCl3制取FeCl2的化学方程式为_______。
②按气流由左到右的方向,上述仪器的连接顺序为____(填字母,装置可多次使用);C中盛放的试剂是_____。
③该制备装置的缺点为______。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按下图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。
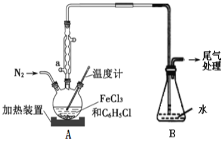
①仪器a的名称是____。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是__,回收滤液中C6H5C1的操作方法是____。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/LNaOH溶液滴定,终点时消耗NaOH溶液为19.60 mL,则氯化铁的转化率为______。
【答案】H2+2FeCl3![]() 2FeCl2+2HCl BACDCE(或BCDCE) 碱石灰 氯化铁易升华导致导管易堵塞 球形冷凝管 苯 蒸馏滤液,并收集沸点132℃的馏分 78.4%
2FeCl2+2HCl BACDCE(或BCDCE) 碱石灰 氯化铁易升华导致导管易堵塞 球形冷凝管 苯 蒸馏滤液,并收集沸点132℃的馏分 78.4%
【解析】
(1)①H2还原无水FeCl3制取FeCl2,另一产物应为含H、Cl的物质,即为HCl,所以化学方程式为H2+2FeCl3![]() 2FeCl2+2HCl。
2FeCl2+2HCl。
答案为:H2+2FeCl3![]() 2FeCl2+2HCl
2FeCl2+2HCl
②因为FeCl3易吸水,所以在氢气通入前,一定要进行干燥处理,即由B装置制得的H2一定要经过C的干燥处理,至于H2中混有的HCl是否处理,问题并不大,因为通过碱石灰处理水蒸气时,HCl也可被吸收。反应后生成的HCl会污染环境,也需用碱石灰处理,多余的氢气应烧掉,从而得出按气流由左到右的方向,上述仪器的连接顺序为BACDCE(或BCDC)。
答案为:BACDCE(或BCDCE
C中盛放的试剂是碱石灰。答案为:碱石灰
③因为氯化铁易升华,则遇冷会凝华,所以装置的缺陷也就暴露出来,即易堵塞导管。
答案为:氯化铁易升华导致导管易堵塞
(2)①仪器a的名称是球形冷凝管。答案为:球形冷凝管
②因为FeCl2易溶于水、乙醇,所以不能用水、乙醇洗涤;FeCl2难溶于苯,而氯苯、二氯苯易溶于苯,所以可用苯进行洗涤。答案为:苯
因为氯苯和二氯苯的沸点相差较大,所以回收滤液中C6H5C1的操作方法是蒸馏滤液,并收集沸点132℃的馏分。答案为:蒸馏滤液,并收集沸点132℃的馏分
③n(FeCl3)=2n(HCl)=2n(NaOH)= 2×0.40mol/L×0.0196L×10=0.1568mol
氯化铁的转化率为![]()
答案为:78.4%