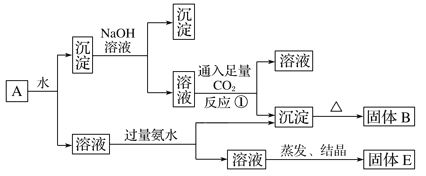
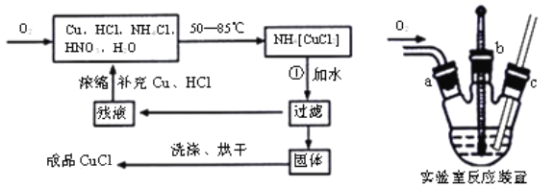
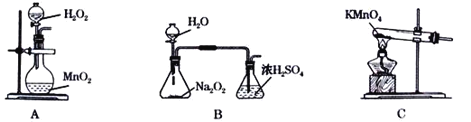
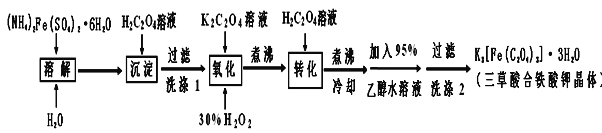
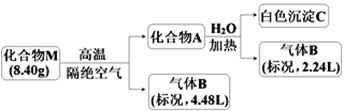
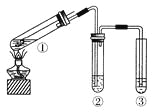
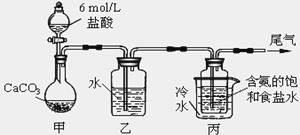
0 197388 197396 197402 197406 197412 197414 197418 197424 197426 197432 197438 197442 197444 197448 197454 197456 197462 197466 197468 197472 197474 197478 197480 197482 197483 197484 197486 197487 197488 197490 197492 197496 197498 197502 197504 197508 197514 197516 197522 197526 197528 197532 197538 197544 197546 197552 197556 197558 197564 197568 197574 197582 203614