题目内容
【题目】Ⅰ.某化合物M(仅含三种短周期元素)是一种储氢材料。为探究M的组成和性质,设计并完成如下实验:
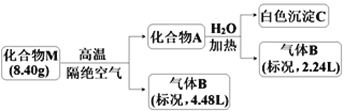
已知:化合物A仅含两种元素;气体B能使湿润的红色石蕊试纸变蓝。
请回答:(1)化合物M的组成元素是______________(用元素符号表示)。
(2)化合物A与水反应的化学方程式是______________________。
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,该反应的化学方程式是______。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,原子个数比为1︰1︰4。将23.8gX与水共热,生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀。请推测并回答:
(4)单质A有很强的氧化性,可用于净化空气,饮用水消毒等。A中组成元素的简单离子结构示意图为___________________________。
(5)X的化学式_____________。
(6)实验室可通过低温电解B溶液制备X。该电解反应的化学方程式___________________。
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫。在碱性条件下,X氧化NO的离子方程式_____________________。
(8)X溶液与铜反应时先慢后快。某同学认为除反应放热这一因素外,还有一种可能是反应生成的Cu2+对后续反应起催化作用,为此他设计了如下实验方案:取少量铜粉置于试管中,先加入少量CuSO4溶液,再加入X溶液,振荡,观察现象。若加入硫酸铜溶液的反应快,说明Cu2+起了催化作用,反之Cu2+不起作用。写出X与铜反应的化学方程式________,判断该同学设计的验证方法合理性并说明理由_________。
【答案】Mg、N、H Mg3N2 + 6H2O == 3Mg(OH)2↓+ 2NH3↑ Mg+2NH3![]() Mg(NH2)2+H2↑
Mg(NH2)2+H2↑ ![]() Na2S2O8 2NaHSO4
Na2S2O8 2NaHSO4![]() Na2S2O8+H2↑ 3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O Na2S2O8+Cu=Na2SO4+CuSO4 该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用
Na2S2O8+H2↑ 3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O Na2S2O8+Cu=Na2SO4+CuSO4 该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用
【解析】
I.气体B(4.48L)能使湿润的红色石蕊试纸变蓝,B为NH3,其物质的量为4.48L÷22.4L/mol=0.2mol,某物质M (仅含三种元素)是一种储氢材料,M隔绝空气高温分解生成固体A和氨气,镁带在足量气体B中燃烧可生成化合物M,证明M中含有N、H、Mg元素,A只含两种元素,A和水反应生成氨气和白色沉淀C,固体A和水反应生成氨气物质的量为0.1mol,白色沉淀C为氢氧化镁沉淀,则A为Mg3N2,物质的量为0.05mol,由元素守恒可知Mg元素物质的量0.15mol,M中含氮元素为0.2mol+0.1mol=0.3mol,所含氢元素物质的量为(8.4g-0.3mol×14g/mol-0.15mol×24g/mol)÷1g/mol=0.6mol,M中元素物质的量之比为n(Mg):n(N):n(H)=0.15:0.3:0.6=1:2:4,可知M化学式为Mg(NH2)2,以此来解答。
II.无机盐X仅由三种短周期元素组成,其相对分子质量为238,23.8gX的物质的量为0.1mol,X与水共热生成一种有特殊臭味的气体单质A和某强酸的酸式盐溶液B,B的焰色反应呈黄色,B中含有Na元素,则X含有Na元素,在溶液B中加入足量的BaCl2溶液,产生46.6g白色沉淀,白色沉淀为BaSO4,其物质的量为0.2mol,根据S原子守恒可知X中含有2个S原子,B为NaHSO4,X中三种元素原子个数比为1:1:4,该无机盐X可以表示为(NaSX4)2,则X元素相对原子质量为16,X为O元素,故A为O3,X为Na2S2O8.
Ⅰ. (1)由上述分析可知,M中含元素为Mg、N、H,
故答案为:Mg、N、H;
(2)化合物A与水反应的化学方程式是Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑,
故答案为:Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑;
(3)镁带在足量气体B中燃烧可生成化合物M和一种单质气体,气体为氢气,则该反应的化学方程式是Mg+2NH3═Mg(NH2)2+H2↑,
故答案为:Mg+2NH3═Mg(NH2)2+H2↑。
II.(4)单质A为O3,组成元素的简单离子结构示意图为:![]() ,故答案为:
,故答案为:![]() ;
;
(5)X的化学式为:Na2S2O8,故答案为:Na2S2O8;
(6)实验室可通过低温电解NaHSO4溶液制备Na2S2O8,电解方程式为:2NaHSO4![]() Na2S2O8+H2↑;
Na2S2O8+H2↑;
(7)X氧化能力强,对环境友好,可用于脱硝、脱硫.在碱性条件下,Na2S2O8氧化NO的离子方程式为:3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O,
故答案为:3S2O82-+2NO+8OH-=6SO42-+2NO3-+4H2O;
(8)Na2S2O8与铜反应的化学方程式:Na2S2O8+Cu=Na2SO4+CuSO4,该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用,
故答案为:Na2S2O8+Cu=Na2SO4+CuSO4;该同学的验证方法不合理,因为加入CuSO4溶液,反应速率快也可能是SO42-起催化作用。

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案