题目内容
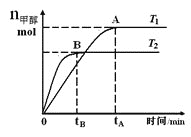
【题目】密闭恒温容器中进行下列反应:aA(g)![]() bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
bB(g),反应达到平衡状态后,将容器容积增大1倍,当反应达到新的平衡状态时,反应物A的浓度是原来的46%,则下列叙述正确的是( )
A.化学计量数a>b
B.容器容积增大,平衡向逆反应方向移动
C.容器容积增大,生成物B的质量分数增大
D.该反应的正反应放出热量
【答案】C
【解析】
将容器容积增大1倍,相当于减小压强,改变条件瞬间,各物质浓度均变为原来的50%,但当反应达到新的平衡状态时,反应物A的浓度是原来的46%,说明平衡正向移动,因此减小压强平衡正向移动,以此分析。
A.减小压强,平衡正向移动,而减小压强,平衡将向气体体积增大的方向移动,因此化学计量数b>a,故A错误;
B.由上述分析可知,容器容积增大,平衡正向移动,故B错误;
C.增大容器体积,平衡正向移动,因此生成物B的质量分数增大,故C正确;
D.因该反应在恒温条件下进行,温度未发生该变,且不确定平衡移动过程中的热效应,因此无法判断反应的热效应,故D错误;
故答案为:C。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案【题目】研究CO和CO2的利用对促进低碳社会的构建具有重要意义。请回答下列问题:
(1)利用CO和H2在一定条件下可合成甲醇,发生反应: CO(g)+ 2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
CH3OH(g),其两种反应过程中能量的变化曲线如图中a、b所示,下列说法正确的是_____(填字母)。
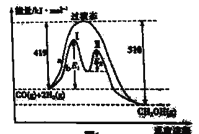
A.上述反应的△H= -91 kJ·mol-1
B.该反应自发进行的条件为高温
C. b过程使用催化剂后降低了反应的活化能和H
D. b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(2)若反应CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
CH3OH(g)在温度不变且体积恒定为1L密闭容器中发生,反应过程中各物质的物质的量随时间变化见表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是_______(填字母)
A.2v正(H2)=v逆(CH3OH)
B. CO与CH3OH的物质的量之比保持不变
C.混合气的平均相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0kPa,反应速率若用单位时间内分压的变化表示,则10 min内H2的反应速率v(H2)=_____kPa/min;该温度下反应的平衡常数Kp=______。(分压=总压×物质的量分数)。
(3)甲和乙两个恒容密闭容器的体积相同,向甲中加入1 mol CO和2 mol H2,向乙中加入2 mol CO和4 molH2,测得不同温度下CO的平衡转化率如图所示,则L、M两点容器内平衡常数:K(M)_____ K(L); 压强:p(M)__2p(L)。(填“>”“<”或“=”)

(4)以纳米二氧化钛为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯(![]() )。电解时,阴极的电极反应式是_________。
)。电解时,阴极的电极反应式是_________。
【题目】25oC时,浓度均为0.1 mol·L–1的几种溶液的pH如下:
溶液 | ①CH3COONa溶液 | ②NaHCO3溶液 | ③CH3COONH4溶液 |
pH | 8.88 | 8.33 | 7.00 |
下列说法不正确的是
A.①中, c(Na+) = c(CH3COO–) + c( CH3COOH)
B.由①②可知,CH3COO–的水解程度大于![]() 的水解程度
的水解程度
C.③中,c(CH3COO–) = c(NH4+) < 0.1 mol·L–1
D.推测25oC,0.1 mol·L–1 NH4HCO3溶液的pH <8.33